题目内容
利用工业炼铜后的炉渣(含Fe2O3、FeO、SiO2、Al2O3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na2FeO4)。其工艺流程如下(部分操作和条件略):
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是 。
(2)验证炉渣中含有FeO必要的化学试剂为 。
(3)已知:生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时 | 1.5 | 3.4 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 8.3 |
①步骤Ⅱ中加入过量NaClO,反应的离子方程式是 。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是 。
(4)该工业流程存在缺点,在步骤Ⅱ伴随着有氯气产生,此反应方程式是 。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是 。
(6)在步骤Ⅳ中,若该反应生成166 g Na2FeO4转移3 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
(1)Fe2O3 + 6H+ = 2Fe3+ + 3H2O (2分)
(2)稀硫酸、KMnO4溶液 (或稀盐酸、K3[Fe(CN)6]溶液)(2分)
(3)①2Fe2+ + ClO- + 2H+ = 2Fe3+ +Cl- + H2O (2分)
②pH约为3时,Fe2+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀。 (2分)
(4)ClO- + Cl- + 2H+ = Cl2 + H2O (2分)
(5)浓缩至饱和,冷却结晶(2分)
(6)2 : 3 (1分)
解析试题分析:(1)稀盐酸溶解Fe2O3:Fe2O3 + 6H+ = 2Fe3+ + 3H2O。
(2)验证FeO先要溶解,是盐酸,在证明Fe2+的检验,可用KMnO4溶液的褪色实验或K3[Fe(CN)6]溶液蓝色沉淀实验。
(3)①步骤Ⅱ中加入过量NaClO,将Fe2+氧化,2Fe2+ + ClO- + 2H+ = 2Fe3+ +Cl- + H2O。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是Fe2+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀。
(4)在步骤Ⅱ伴随着有氯气产生是因为:ClO- + Cl- + 2H+ = Cl2 + H2O。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是浓缩至饱和、冷却结晶。
(6)在步骤Ⅳ中发生反应,生成166 g Na2FeO4转移3 mol电子,3NaClO+4NaOH+2Fe(OH)3=2Na2FeO4+ 3NaCl + 5H2O。反应则参加反应的还原剂Fe(OH)3和氧化剂NaClO的物质的量之比是2:3。
考点:化学技术的应用问题。考查氧化铁的溶解、低价铁元素的检验,氢氧化物的沉淀调节,晶体的制备方法等。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案下列除杂方法合理的是
| A.C2H6中混有的C2H4,可以将混合气体先通过溴水,然后用碱石灰干燥 |
| B.CaCO3中混有的少量NaHCO3,可以用加热的方法除去 |
| C.乙烯中混有的SO2气体,可以通过酸性高锰酸钾溶液除去 |
| D.H2S中混有的水蒸气,可以用浓硫酸除去 |
有一无色透明溶液,欲确定是否含有下列离子: Fe2+、Mg2+、Al3+、Ba2+、 、
、 、Cl-、I-、
、Cl-、I-、 ,取该溶液进行实验:
,取该溶液进行实验:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊试液 | 溶液变红 |
| (2)取少量该溶液加热,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有白色沉淀,且不溶于稀HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀,NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定不存在的离子有 ,溶液中肯定存在的离子是 。
(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论) 。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。
② Cr2O72-+ H2O 2CrO42-+ 2H+
2CrO42-+ 2H+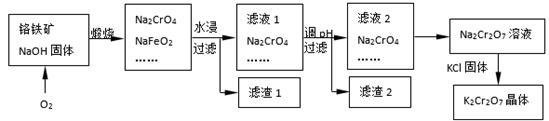
(1)K2Cr2O7中Cr元素的化合价是 。
(2)滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式) ;
生成滤渣1中红褐色物质反应的化学方程式是。
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是。
(4)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(5)莫尔法是一种沉淀滴定法,以Na2CrO4 为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
①滴定终点的现象是。
②若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是(选填编号)
A.NaCl B.K2CrO4 C.BaBr2