题目内容
下列除杂方法合理的是
| A.C2H6中混有的C2H4,可以将混合气体先通过溴水,然后用碱石灰干燥 |
| B.CaCO3中混有的少量NaHCO3,可以用加热的方法除去 |
| C.乙烯中混有的SO2气体,可以通过酸性高锰酸钾溶液除去 |
| D.H2S中混有的水蒸气,可以用浓硫酸除去 |
A
解析试题分析: A项,先通过溴水,除去乙烯,再用碱石灰干燥,正确。B项,CaCO3也可加热分解,错误。C项,酸性高锰酸钾既可氧化SO2,也可氧化乙烯,错误。D项,H2S具有还原性,可被浓硫酸氧化,错误。
考点:基础实验。考察学生对分离和提纯的掌握情况。

有编号为A、B、C、D的四瓶无色液体,仅知道是1%酚酞、0.1mol·L-1NaOH溶液、0.1mol·L-1盐酸和0.1mol·L-1NaCl溶液。化学老师现要求甲、乙、丙、丁四位学生对它们进行鉴别,规定每人只需鉴别两瓶溶液,如果两瓶溶液鉴别都正确,得满分,如果只有一瓶鉴别正确,则算及格。以下是四位学生的鉴别结果:
| A | A为0.1mol·L -1盐酸 | D为0.lmol·L-1NaCl溶液 | 老师评价:四位学生都及格,但是没有一个得满分 |
| B | A为0.1mol·L -1NaOH溶液 | C为0.1mol·L-1盐酸 | |
| C | A为1%酚酞 | B为0.1mol·L-1盐酸 | |
| D | D为0.1mol·L-1盐酸 | B为0.1mol·L-1 NaOH溶液 |
下列结论正确的是
A.A为1%酚酞 B.B为0.1mol·L-1NaCl溶液
C.C为0.1mol·L-1NaOH溶液 D.D为0.1mol·L-1盐酸
有机物的除杂方法中正确的是(括号中的是杂质)
| A.乙酸(乙醛):加入新制的氢氧化铜,加热 |
| B.苯(苯酚):加入溴水,过滤 |
| C.溴乙烷(溴单质):加入热氢氧化钠溶液洗涤,分液 |
| D.乙酸乙酯(乙酸):加入饱和碳酸钠溶液洗涤,分液 |
用下列实验装置进行相应实验.能达到实验目的的是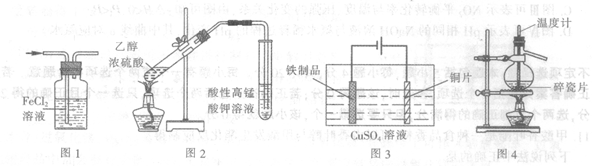
| A.用图1所示装置除去HCl气体中的少量C12 |
| B.用图2所示装置检验加热时产生的乙烯 |
| C.用图3所示装置在铁制品表面镀铜 |
| D.用图4所示装置分离溴的四氯化碳溶液 |
下列使用漏斗的几个实验装置中,设计正确且能达到实验目的的是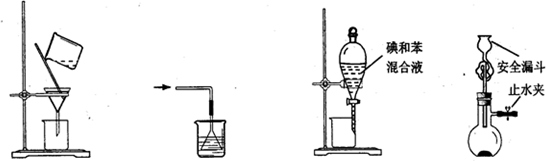
图1 图2 图3 图4
| A.用图1所示装置进行过滤,过滤时不断搅拌 |
| B.用图2所示装置吸收NH3制氨水 |
| C.用图3所示装置用苯萃取碘水中的碘,并把碘的苯溶液从漏斗下口放出 |
| D.用图4所示装置用石灰石与稀盐酸制取CO2气体 |
适宜用分液漏斗进行分离的一组混合物是( )
| A.乙酸和乙醇 | B.水和氯化钠 | C.水和花生油 | D.四氯化碳和碘 |
下列实验能达到目的的是
| A.用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸 |
| B.用NaOH溶液与FeCl3溶液制备Fe(OH)3胶体 |
| C.用品红和盐酸检验Na2SO3和Na2CO3 |
| D.将混有乙烯的SO2通入酸性KMnO4溶液中除去乙烯 |
下列各组溶液,不用其它试剂,无法将它们区别开的是
| A.HCl、CuSO4、Mg(NO3)2、KOH | B.NaBr、AgNO3、HCl、Na2CO3 |
| C.H2SO4、NaCl、Na2SO4、Na2CO3 | D.NaOH、MgSO4、Na2CO3、KHSO4 |
利用工业炼铜后的炉渣(含Fe2O3、FeO、SiO2、Al2O3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na2FeO4)。其工艺流程如下(部分操作和条件略):
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是 。
(2)验证炉渣中含有FeO必要的化学试剂为 。
(3)已知:生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时 | 1.5 | 3.4 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 8.3 |
①步骤Ⅱ中加入过量NaClO,反应的离子方程式是 。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是 。
(4)该工业流程存在缺点,在步骤Ⅱ伴随着有氯气产生,此反应方程式是 。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是 。
(6)在步骤Ⅳ中,若该反应生成166 g Na2FeO4转移3 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。