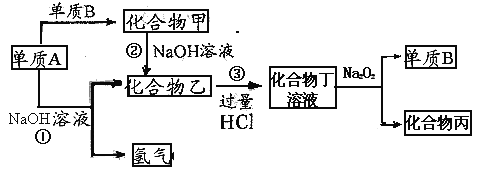
��Ŀ����
����Ŀ��������������ij�����Ͳ�ͬ�¶������ɵIJ�����ͼ��ʾ����֪��800���£��ݻ��̶����ܱ������з�����Ӧ�١��ڣ�
4NH3��g��+3O2��g�� ![]() 2N2��g��+6H2O��g������
2N2��g��+6H2O��g������
4NH3��g��+5O2��g�� ![]() 4NO��g��+6H2O��g������
4NO��g��+6H2O��g������
����������˵������Ӧ���ﵽƽ����ǣ� ��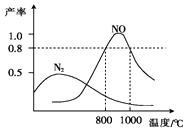
A.v��N2��=v��NO��
B.��Ӧ�ٵ��ʱ��H���ֺ㶨
C.��ϵ���ܶȲ��ٷ����仯
D.��������ƽ����Է����������ٷ����仯
���𰸡�D
���������⣺A��v��N2��=v��NO����δ�������淴Ӧ�Ĺ�ϵ����A����
B��ֻҪ��ѧ����ʽ���䣬���H���ֺ㶨����ƽ��״̬�أ���B����
C������������䣬��Ӧǰ�������壬��������ʼ�ղ��䣬˵���ܶ�ʼ�ղ��䣬�ܶȲ��䲻��˵����Ӧ�ﵽƽ��״̬����C����
D����������ƽ����Է����������ٷ����仯��˵���������ʵ������䣬�Ѵ�ƽ�⣬��D��ȷ��
��ѡD��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���ʼ����������֪ʶ�����ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����

����Ŀ��һ����Na2O2��NaHCO3�����Ϻ����ܱ������м��ȳ�ַ�Ӧ���ų��������ʣ�����ȴ���Բ����������ʵķ������±��в���ȷ���ǣ� ��
Na2O2/mol | NaHCO3/mol | ������������ | |
A | 1 | 2 | Na2CO3 |
B | 1.5 | 2 | Na2O2 Na2CO3 |
C | 2 | 1 | Na2O2 NaOH Na2CO3 |
D | 2 | 2 | NaOH Na2CO3 |
A. A B. B C. C D. D
����Ŀ��ij�¶��£���Ӧ��2A��g��B��g��+C��g����ƽ�ⳣ��Ϊ1�����ݻ�Ϊ2L���ܱ������м���A��g����20sʱ��ø���ֵ����ʵ������±�������˵����ȷ���ǣ� ��
���� | A��g�� | B��g�� | C��g�� |
���ʵ���/mol | 1.2 | 0.6 | 0.6 |
A.��Ӧǰ20 s�ڵ�ƽ����Ӧ����Ϊv��A��=0.6 molL��1s��1
B.20 sʱ������Ӧ���ʴ����淴Ӧ����
C.�ﵽƽ��ʱ��A��g����ת����Ϊ100%
D.�������¶�ƽ�ⳣ����Ϊ2����Ӧ�ġ�H��0