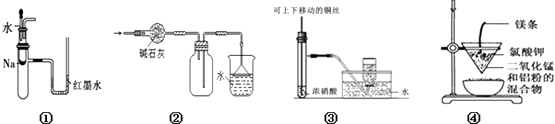
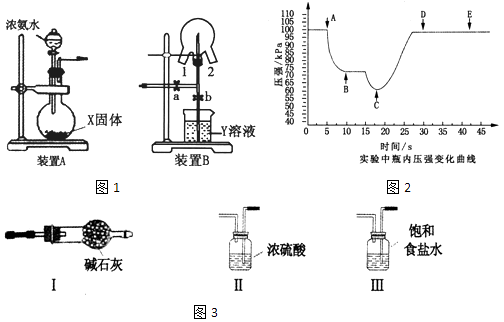
题目内容
【题目】25℃,101k Pa时,已知下列可逆反应的焓变和化学平衡常数分别为:
①A(g)+2B(g)2C(g)+2D(l)△H1=﹣250.kJmol﹣1 K1=0.2
②E(s)+B(g)C(g)△H2=﹣310kJmol﹣1K2=2
③F(g)+ ![]() B(g)D(l)△H3=﹣200kJmol﹣1K3=0.8
B(g)D(l)△H3=﹣200kJmol﹣1K3=0.8
(1)写出反应 ①的平衡常数表达式K1= , 升高反应①的温度,反应①的平衡常数 , 增大压强,反应①的平衡常数(填“增大”或“减小”或“不变”)
(2)反应2F(g)+B(g)2D(l)△H= , 反应②的逆反应的平衡常数K4=
(3)反应2E(s)+2F(g)+B(g)A(g)的△H= , K= .
【答案】
(1)![]() ;减小;不变
;减小;不变
(2)﹣400 kJ?mol﹣1;0.5
(3)﹣770KJ/mol;12.8
【解析】解:(1)生成物浓度幂之积比上反应物浓度幂之积,所以K= ![]() ,正反应是放热反应,温度升高,平衡常数减小,平衡常数是温度的函数,压强改变平衡不移动,所以增大压强,平衡常数不变,所以答案是:
,正反应是放热反应,温度升高,平衡常数减小,平衡常数是温度的函数,压强改变平衡不移动,所以增大压强,平衡常数不变,所以答案是: ![]() ;减小;不变;(2)反应2F(g)+B(g)2D(l),所以反应热是原计量数的2倍,则△H=﹣200kJmol﹣1×2=)﹣400 kJmol﹣1 , 根据平衡常数与反应的关系可知,逆反应的平衡常数为原反应平衡常数的倒数,所以K4=
;减小;不变;(2)反应2F(g)+B(g)2D(l),所以反应热是原计量数的2倍,则△H=﹣200kJmol﹣1×2=)﹣400 kJmol﹣1 , 根据平衡常数与反应的关系可知,逆反应的平衡常数为原反应平衡常数的倒数,所以K4= ![]() =
= ![]() =0.5,所以答案是:﹣400 kJmol﹣1;0.5;(3)根据盖斯定律,将③×2+②×2﹣①可得反应2E(s)+2F(g)+B(g)A(g),所以此反应的反应热△H=△H3×2+△H2×2﹣△H1=(﹣310×2﹣200×2+250)kJmol﹣1=﹣770KJ/mol,根据平衡常数与反应的关系可知,两反应相加,则平衡常数相乘,反应取2倍,则平衡常数取其平方,所以K=
=0.5,所以答案是:﹣400 kJmol﹣1;0.5;(3)根据盖斯定律,将③×2+②×2﹣①可得反应2E(s)+2F(g)+B(g)A(g),所以此反应的反应热△H=△H3×2+△H2×2﹣△H1=(﹣310×2﹣200×2+250)kJmol﹣1=﹣770KJ/mol,根据平衡常数与反应的关系可知,两反应相加,则平衡常数相乘,反应取2倍,则平衡常数取其平方,所以K= ![]() =
= ![]() =12.8,所以答案是:﹣770KJ/mol;12.8.
=12.8,所以答案是:﹣770KJ/mol;12.8.
【考点精析】本题主要考查了化学平衡状态本质及特征和化学平衡的计算的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案