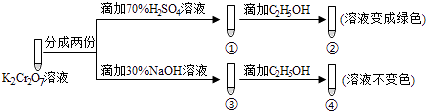
题目内容
【题目】下列氧化还原反应中,水作为氧化剂的是( )
A. C+H2O(g)![]() CO+H2 B. 3NO2+H2O===2HNO3+NO
CO+H2 B. 3NO2+H2O===2HNO3+NO
C. 2Na2O2+2H2O===4NaOH+O2↑ D. 2F2+2H2O===4HF+O2
【答案】A
【解析】试题分析:A.在反应C+H2O![]() CO+H2中,水中的氢元素是+1价,反应后变为氢气中的0价,化合价降低,获得电子,被还原,因此水作氧化剂,正确;B.在3NO2+H2O=2HNO3+NO中NO2中的N元素化合价是+4价,反应后变为HNO3中的+5价,化合价升高,失去电子,NO2作还原剂;NO2中的N元素化合价是+4价,反应后变为NO中的+2价,化合价降低,获得电子,NO2作氧化剂,因此而水中的元素化合价在反应前后不变,因此不作氧化剂,也不作还原剂,错误;C.在反应2Na2O2+2H2O=4NaOH+O2↑中,水中的元素在反应前后元素的化合价没有发生变化,因此既不作氧化剂,也不作还原剂,错误;D.在反应2F2+2H2O=4HF+O2中,水中的氧元素反应前是-2价,反应后变为O2中的0价,化合价升高,失去电子,水作还原剂,错误。
CO+H2中,水中的氢元素是+1价,反应后变为氢气中的0价,化合价降低,获得电子,被还原,因此水作氧化剂,正确;B.在3NO2+H2O=2HNO3+NO中NO2中的N元素化合价是+4价,反应后变为HNO3中的+5价,化合价升高,失去电子,NO2作还原剂;NO2中的N元素化合价是+4价,反应后变为NO中的+2价,化合价降低,获得电子,NO2作氧化剂,因此而水中的元素化合价在反应前后不变,因此不作氧化剂,也不作还原剂,错误;C.在反应2Na2O2+2H2O=4NaOH+O2↑中,水中的元素在反应前后元素的化合价没有发生变化,因此既不作氧化剂,也不作还原剂,错误;D.在反应2F2+2H2O=4HF+O2中,水中的氧元素反应前是-2价,反应后变为O2中的0价,化合价升高,失去电子,水作还原剂,错误。

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目