��Ŀ����
����Ŀ��ԭ��ؿɽ���ѧ��ת��Ϊ���ܣ�����������͵�ԭ��أ�̽��������ת��Ч�ʣ���ѡ���ϣ�ZnSO4��aq����CuSO4��aq����ͭƬ��пƬ�͵��ߣ�
��1�������ԭ��ؼ�װ��ʾ��ͼ����ͼ����������Ӧ��ע��Ҫ����ͬһ�ձ��У��缫����Һ����ͬ�Ľ���Ԫ���� 
����ͭƬΪ�缫֮һ��CuSO4��aq��Ϊ�������Һ��ֻ��һ���ձ�����װԭ����ң�����һ��ʱ��ɹ۲쵽���� ��
�ۼ�������ԭ����пɸ���Ч�ؽ���ѧ��ת��Ϊ���ܵ��� �� ��ԭ���� ��
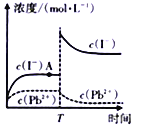
����������CuSO4��Һ��Ǩ�Ƶ�������������ţ�
A��K+ B��NO3�� C��Ag+ D��SO42��
��2�����ԭ���ڻ�ѧ��ҵ�����Ź㷺��Ӧ�ã��ֽ�����Ƶ�ԭ���ͨ��������ͼ2�е������������У�aΪ���Һ��X��Y������缫�壬�� ����X��Y��Ϊ���Ե缫��aΪCuSO4��Һ������ʱ�Ļ�ѧ��Ӧ����ʽΪ �� ͨ��һ��ʱ�����������Һ�м���0.2molCuO��ĩ��ǡ�ûָ����ǰ��Ũ�Ⱥ�pH�����������ת�Ƶĵ��ӵ����ʵ���Ϊ ��
����X��Y�ֱ�Ϊ����ͭ��a��ΪCuSO4��Һ����Y���ĵ缫��ӦʽΪ ��
���𰸡�
��1��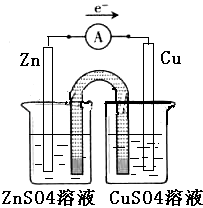 ���缫���ܽ⣻�ף��ڼ�װ����,��������Cu2+�Ӵ�,������Cu2+ֱ���븺��������Ӧ��ʹ��ѧ��ת��Ϊ���ܣ� A
���缫���ܽ⣻�ף��ڼ�װ����,��������Cu2+�Ӵ�,������Cu2+ֱ���븺��������Ӧ��ʹ��ѧ��ת��Ϊ���ܣ� A
��2��2CuSO4+2H2O ![]() 2Cu+O2��+2H2SO4��0.4mol�� Cu��2e��=Cu2+
2Cu+O2��+2H2SO4��0.4mol�� Cu��2e��=Cu2+
���������⣺��1������ͬһ�ձ��У��缫����Һ����ͬ�Ľ���Ԫ�أ���ͼʾ���ԭ��أ�п��������ͭ��������ԭ��صļ�װ��ʾ��ͼΪ��  �����Դ��ǣ�
�����Դ��ǣ�  ��
��
����ͭƬΪ�缫֮һ��CuSO4��aq��Ϊ�������Һ��ֻ��һ���ձ�����װԭ����ң�����ԭ��ط�Ӧ��ԭ������Ҫѡ�ñ�ͭ���õ�п���������²�ԭ��أ���������������Ӧ��Zn��2e��=Zn2+��п�ܽ⣬���Դ��ǣ��缫���ܽ⣻
�ۼ�������ԭ����пɸ���Ч�ؽ���ѧ��ת��Ϊ���ܵ��Ǽף���Ϊ���Ա��ֵ����ȶ�����ѧ�ܻ�����ת��Ϊ���ܣ������еĻ��ý�����������CuSO4��Һ�����û���Ӧ����������ת��Ϊ���ܣ�
���Դ��ǣ��ף����Ա��ֵ����ȶ�����ѧ�ܻ�����ת��Ϊ���ܣ������еĻ��ý�����������CuSO4��Һ�����û���Ӧ����������ת��Ϊ���ܣ�
��������������������Ǩ�ƣ���������Ǩ�ƣ�������������CuSO4��Һ��Ǩ�Ƶ������Ǽ����ӣ���ѡA����2���ٵ������ͭ��Һʱ����������������������������ͭ��ͬʱ��Һ���������ᣬ���ԣ������缫��ӦΪ��4OH����4e��=H2O+O2������ط�ӦʽΪ��2CuSO4+2H2O ![]() 2Cu+O2��+2H2SO4������ͭԭ���غ�֪������ͭ��ͭ�ı���1��1������0.2molCuO������0.2molͭ��ת�Ƶ��ӵ����ʵ���=0.2mol��2=0.4mol��
2Cu+O2��+2H2SO4������ͭԭ���غ�֪������ͭ��ͭ�ı���1��1������0.2molCuO������0.2molͭ��ת�Ƶ��ӵ����ʵ���=0.2mol��2=0.4mol��
���Դ��ǣ�2CuSO4+2H2O ![]() 2Cu+O2��+2H2SO4��0.4mol��
2Cu+O2��+2H2SO4��0.4mol��
����X��Y����Ϊ����ͭ��a��ΪCuSO4��Һ���ж�X������YΪ����������ͭʧ��������ͭ���ӣ�Y���缫��ӦΪCu��2e��=Cu2+��
���Դ��ǣ�Cu��2e��=Cu2+��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�