��Ŀ����
����Ŀ��̼���γɻ�������������Ԫ��,�䵥�ʼ������������������������Ҫ��Դ���ʡ���ش��������⡣
��1���л���M����̫������տ�ת����N,ת����������:
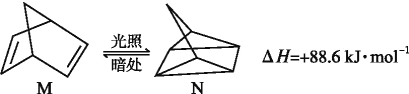
��M��N���, ���ȶ�����____��
��2������͵�������ı������������ʡ���ʯī�����ۺͶ������Ѱ�һ����������ڸ���������,�������ʿ������²���,4Al(s)+3TiO2(s)+3C(s)![]() 2Al2O3(s)+3TiC(s)����H=-1 176 kJ��mol-1,��Ӧ������,ÿת��1 mol���ӷų�������Ϊ________
2Al2O3(s)+3TiC(s)����H=-1 176 kJ��mol-1,��Ӧ������,ÿת��1 mol���ӷų�������Ϊ________
��3����֪��1 mol H��H����1 mol N��H����1 mol N��N���ֱ���Ҫ��������436 kJ��391 kJ��946 kJ,��N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ_________________
��4�����������Ȼ�ѧ����ʽ��
��C(s)��O2(g)===CO2(g)����H1����393.5 kJ��mol��1��
��H2(g)��1/2O2(g)===H2O(l)����H2����285.8 kJ��mol��1��
��CH3COOH(l)��2O2(g)===2CO2(g)��2H2O(l) ��H3����870.3 kJ��mol��1
���Լ����2C(s)��2H2(g)��O2(g)===CH3COOH(l)�ķ�Ӧ��Ϊ________
���𰸡� M 98kJ N2(g)+3H2(g) ![]() 2NH3(g) ��H����92 kJ��mol��1 ��488.3 kJ��mol��1
2NH3(g) ��H����92 kJ��mol��1 ��488.3 kJ��mol��1
������������:(1) Mת����NΪ���ȷ�Ӧ����1molM���е�����������1molN���е���������M���ȶ���
(2)������Ӧ��ת��12������,��ÿת��1mol���ӷų�������Ϊ![]() =98 kJ��
=98 kJ��
��3���ڷ�ӦN2+3H2![]() 2NH3�У�����3molH-H����1mol N�� N�������յ�����Ϊ��3��436kJ+946kJ=2254kJ������2mol NH3�����γ�6mol N-H�����ų�������Ϊ��6��391kJ=2346kJ�����յ������٣��ų��������࣬�÷�ӦΪ���ȷ�Ӧ���ų�������Ϊ��2346kJ-2254kJ=92kJ��
2NH3�У�����3molH-H����1mol N�� N�������յ�����Ϊ��3��436kJ+946kJ=2254kJ������2mol NH3�����γ�6mol N-H�����ų�������Ϊ��6��391kJ=2346kJ�����յ������٣��ų��������࣬�÷�ӦΪ���ȷ�Ӧ���ų�������Ϊ��2346kJ-2254kJ=92kJ��
��4�������Ȼ�ѧ����ʽ��˹���ɽ��з�������,ͨ���Ȼ�ѧ����ʽ����2������2����ټ�ȥ����ȥ������̼��ˮ�õ�������Ȼ�ѧ����ʽ��ע���Ȼ�ѧ����ʽ�ı�ϵ�����ʱ���֮�ı���
���:(1)�л���M����̫������տ�ת����N,
��H��+88.6 kJ��mol��1�����������ȷ�Ӧ��N����ת��ΪM���Ƿ��ȷ�Ӧ������Խ��Խ�ȶ�,˵��M�ȶ���
��ˣ�������ȷ����:M��
(2) 4Al(s)+3TiO2(s)+3C(s)![]() 2Al2O3(s)+3TiC(s)�� ��H=-1 176 kJ��mol-1,ת��12mol���ӷ���1 176 kJ,��Ӧ������,ÿת��1mol���ӷ���98 kJ��
2Al2O3(s)+3TiC(s)�� ��H=-1 176 kJ��mol-1,ת��12mol���ӷ���1 176 kJ,��Ӧ������,ÿת��1mol���ӷ���98 kJ��
��ˣ�������ȷ����: 98 kJ��
(3)�ڷ�ӦN2+3H2![]() 2NH3�У�����3molH-H����1mol N�� N�������յ�����Ϊ��3��436kJ+946kJ=2254kJ������2mol NH3�����γ�6mol N-H�����ų�������Ϊ��6��391kJ=2346kJ�����յ������٣��ų��������࣬�÷�ӦΪ���ȷ�Ӧ���ų�������Ϊ��2346kJ-2254kJ=92kJ����N2(g)+3H2(g)=2NH3(g) ��H=-92kJ��mol-1���ʴ�Ϊ��N2(g)+3H2(g)=2NH3(g) ��H=-92kJ��mol-1
2NH3�У�����3molH-H����1mol N�� N�������յ�����Ϊ��3��436kJ+946kJ=2254kJ������2mol NH3�����γ�6mol N-H�����ų�������Ϊ��6��391kJ=2346kJ�����յ������٣��ų��������࣬�÷�ӦΪ���ȷ�Ӧ���ų�������Ϊ��2346kJ-2254kJ=92kJ����N2(g)+3H2(g)=2NH3(g) ��H=-92kJ��mol-1���ʴ�Ϊ��N2(g)+3H2(g)=2NH3(g) ��H=-92kJ��mol-1
��4����C(s)��O2(g)===CO2(g)����H1����393.5 kJ��mol��1��
��H2(g)��1/2O2(g)===H2O(l)����H2����285.8 kJ��mol��1��
��CH3COOH(l)��2O2(g)===2CO2(g)��2H2O(l) ��H3����870.3 kJ��mol��1
���ݸ�˹�������Ȼ�ѧ����ʽ����2+����2-���õ�: ��H����488.3 kJ��mol��1��