题目内容
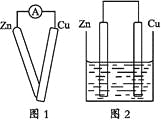
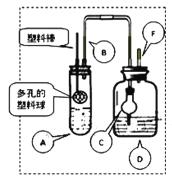
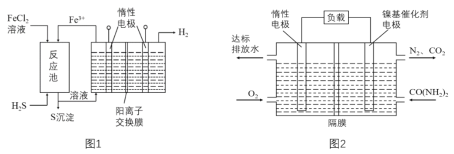
【题目】绿色化学,体现了人类可持续发展的客观要求。尿素电氧化法在碱性条件下将工业废水和生活污水富含的尿素转化为对环境无害的物质,并将化学能转化电能(图1),由尿素电氧化法产生的电能可供治理硫化氢(图2)。
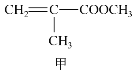
(1)写出CO(NH2)2的电子式:___。
(2)尿素电氧化法负极发生的反应为:___,隔膜为___(填“阴”或“阳”)离子交换膜。
(3)先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用,见图1。
①处理掉废水中尿素,消耗22.4L O2(标准状况下)时,可供治理硫化氢,产生___gS沉淀;电解池的溶液中,溶质是___。
②阳极的电极反应式为___。
③电解总反应的离子方程式是___。
【答案】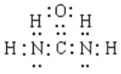 CO(NH2)2+6OH― ―6e―=N2↑+CO2↑+5H2O 阴 64 FeCl2、HCl Fe2+-e-=Fe3+ 2Fe2++2H+
CO(NH2)2+6OH― ―6e―=N2↑+CO2↑+5H2O 阴 64 FeCl2、HCl Fe2+-e-=Fe3+ 2Fe2++2H+![]() 2Fe3++H2↑
2Fe3++H2↑
【解析】
(1)CO(NH2)2为共价化合物,电子式为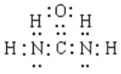 。
。
(2)电池中通氧气的一端为原电池正极,得电子,发生还原反应生,成氢OH-,通入尿素的一端为负极,尿素失电子,发生氧化反应,生成氮气和二氧化碳,电极反应为CO(NH2)2-6e-+6OH-=CO2↑+N2↑+5H2O;在碱性条件下产生二氧化碳,氮气,正极生成氢氧根,负极消耗氢氧根,所以隔膜只允许阴离子通过;
(3)①用三氯化铁溶液吸收含硫化氢的工业废气,发生氧化还原反应,生成氯化亚铁,硫单质和氯化氢,方程式为:2FeCl3+H2S=2FeCl2+S+2HCl,可知得到的溶液中的溶质为FeCl2和HCl;O2可与H2S反应生成S单质,反应方程式为2H2S+O2=2S↓+2H2O,消耗1mol氧气的同时生成S 2mol,m(S)=2mol×32g/mol=64g;
②溶液用惰性电极电解,阳极的电极反应为亚铁离子失去电子发生氧化反应,电极反应为:Fe2+-e-=Fe3+;
③电解总反应是酸性溶液中氢离子移向阴极发生还原反应,生成氢气,阳极亚铁离子失去电子发生氧化反应,方程式为:2Fe2++2H+![]() 2Fe3++H2↑。
2Fe3++H2↑。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案