��Ŀ����
����Ŀ��SOCl2��һ��Һ̬������е�Ϊ77�森��ʢ��10mLˮ����ƿ�У�С�ĵμ�8��10��SOCl2 �� �ɹ۲쵽���ҷ�Ӧ��Һ���������γɣ������д̼�����ζ�����ݳ����������к��п�ʹƷ����Һ��ɫ�����壮��������ƿ����������ʧ������Һ�еμ�AgNO3��Һ���в�����HNO3�İ�ɫ����������
��1����������ʵ������д��SOCl2��ˮ��Ӧ�Ļ�ѧ����ʽ�� ��
��2������AlCl3��Һ���ܵõ���ˮAlCl3 �� д���йط�Ӧ�Ļ�ѧ����ʽ��������ʹSOCl2��AlCl36H2O��ϼ��ȣ����Եõ���ˮAlCl3 �� �Խ���ԭ�� ��
��3����֪������KSP[Al��OH��3]=1.3��10��33 �� ����ʼc��AlCl3��=1.0molL��1����Al3+��ʼ����ʱ��c��H+����molL��1 ��
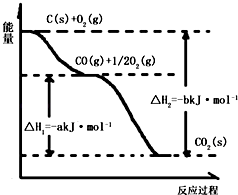
��4��Al2O3��s��+AlCl3��g��+3C��s���T3AlCl��g��+3CO��g����H1=akJmol��1��3AlCl��g���T2Al��l��+AlCl3��g����H2=bkJmol��1��
��ӦAl2O3��s��+3C��s���T2Al��l��+3CO��g���ġ�H=kJmol��1���ú�a��b�Ĵ���ʽ��ʾ����
���𰸡�
��1��SOCl2+H2O=SO2��+2HCl��
��2��AlCl3+3H2O ![]() Al��OH��3��+3HCl��2Al��OH��3
Al��OH��3��+3HCl��2Al��OH��3 ![]() Al2O3+3H2O��SOCl2��ˮ��Ӧ�ȼ�����ˮ���������ɵ�HCl��������AlCl3��ˮ�⣬�����ܵõ��Ȼ�������
Al2O3+3H2O��SOCl2��ˮ��Ӧ�ȼ�����ˮ���������ɵ�HCl��������AlCl3��ˮ�⣬�����ܵõ��Ȼ�������
��3��1.0��10��3
��4��a+b
���������⣺��1��SOCl2��ˮ���ҷ�Ӧ��Һ�����а������ɣ�˵�����ɵ�������ˮ�������γ�СҺ�Σ��Ȱ�����ʧ������Һ�еμ�AgNO3��Һ���в�����HNO3�İ�ɫ����״����������˵�����ɵİ�����ϡ���ᣬ�������к���HCl�����������壬��������ʹƷ����Һ��ɫ˵�����������Ư���ԣ�����Ԫ���غ�֪���������к��ж����������Ը÷�Ӧ����ʽΪSOCl2+H2O=SO2��+2HCl�������Դ��ǣ�SOCl2+H2O=SO2��+2HCl������2���Ȼ�����ˮ����������������ϡ���ᣬ������лӷ��ԣ����ȴٽ��Ȼ���ˮ�⣬����ʱ�õ��Ĺ��������������������������������������ֽ�������������ˮ���������յõ��Ĺ���������������Ӧ�Ļ�ѧ����ʽΪ��AlCl3+3H2O ![]() Al��OH��3��+3HCl��2Al��OH��3
Al��OH��3��+3HCl��2Al��OH��3 ![]() Al2O3+3H2O��SOCl2��ˮ���ҷ�Ӧ����HCl������������ˮ�⣬��SOCl2��ˮ��Ӧ�ȼ�����ˮ�����������ܵõ��Ȼ������壬���Դ��ǣ�AlCl3+3H2O
Al2O3+3H2O��SOCl2��ˮ���ҷ�Ӧ����HCl������������ˮ�⣬��SOCl2��ˮ��Ӧ�ȼ�����ˮ�����������ܵõ��Ȼ������壬���Դ��ǣ�AlCl3+3H2O ![]() Al��OH��3��+3HCl��2Al��OH��3
Al��OH��3��+3HCl��2Al��OH��3 ![]() Al2O3+3H2O��SOCl2��ˮ��Ӧ�ȼ�����ˮ���������ɵ�HCl��������AlCl3��ˮ�⣬�����ܵõ��Ȼ������壻��3����֪������KSP[Al��OH��3]=1.3��10��33 �� ����ʼc��AlCl3��=1.0molL��1 �� C��Al3+��c3��OH����=KSP[Al��OH��3]=1.3��10��33
Al2O3+3H2O��SOCl2��ˮ��Ӧ�ȼ�����ˮ���������ɵ�HCl��������AlCl3��ˮ�⣬�����ܵõ��Ȼ������壻��3����֪������KSP[Al��OH��3]=1.3��10��33 �� ����ʼc��AlCl3��=1.0molL��1 �� C��Al3+��c3��OH����=KSP[Al��OH��3]=1.3��10��33
c��OH����= ![]() ��1.0��10��11mol/L��c��H+��=
��1.0��10��11mol/L��c��H+��= ![]() ��1.0��10��3mol/L����Al3+��ʼ����ʱ��c��H+����1.0��10��3mol/L�����Դ��ǣ�1.0��10��3����4����Al2O3��s��+AlCl3��g��+3C��s���T3AlCl��g��+3CO��g����H1=akJmol��1����3AlCl��g���T2Al��l��+AlCl3��g����H2=bkJmol��1�����ݸ�˹���ɼ����+�ڵõ������Ȼ�ѧ����ʽ��Al2O3��s��+3C��s���T2Al��l��+3CO��g����H=��a+b��KJ/mol�����Դ��ǣ�a+b��
��1.0��10��3mol/L����Al3+��ʼ����ʱ��c��H+����1.0��10��3mol/L�����Դ��ǣ�1.0��10��3����4����Al2O3��s��+AlCl3��g��+3C��s���T3AlCl��g��+3CO��g����H1=akJmol��1����3AlCl��g���T2Al��l��+AlCl3��g����H2=bkJmol��1�����ݸ�˹���ɼ����+�ڵõ������Ȼ�ѧ����ʽ��Al2O3��s��+3C��s���T2Al��l��+3CO��g����H=��a+b��KJ/mol�����Դ��ǣ�a+b��