��Ŀ����
����Ŀ������к͵ζ��������кͷ�Ӧ������֪Ũ�ȵ��ᣨ�����ⶨδ֪Ũ�ȵļ���ᣩ�����鷽����������һ��Ũ�ȵ�����������Һ�ζ�һ��Ũ�ȵ����ᣬ�����Һ��pH�仯���жϵζ��յ�����ݣ�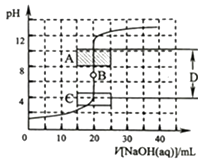
��1��Ϊ��ȷ����ͼ2���ڵζ���ʼʱ�� �� ��Һ�ٶȿ����Կ�һ�㣬���Ժͼ�¼pH�ļ���ɴ�Щ�����ӽ�ʱ����Һ�ٶ�Ӧ����һЩ������ÿ��һ�ξͲ���һ�Σ�
��2����ͼ2��A��pH��Χʹ�õ�ָʾ������C��pH��Χʹ�õ�ָʾ������B������D���ɳ�Ϊ ��
��3����������ϡ��Һ�����ΪA��0.0100molL��1������������Һ�����ΪB��0.100molL��1�����ᣮ���豾�����漰���ĸ���ϡ��Һ���ܶȾ�����Ϊ1.00gmL��1 �� ��ÿ����Һ���������Ϊ0.05mL����ʢ��20.0mLA��Һ����ƿ�еμ�1�η�̪��Һ�����õζ�������ƿ�е���10.0mLB��Һ���ߵα�����ֻ�Ϻ���Һ����ɫ����ȡ����ɫ���Һ3.00mL��һ֧�Թ��ڣ������Թ��ڵμ�1��A��Һ����ͨ������˵����ʱ�Թ�����Һ���ֵ���ɫ ��
���𰸡�
��1���ζ��յ�ζ��յ�
��2����̪�����ȣ��ζ��յ㣻pHͻ�䷶Χ
��3����ɫ
���������⣺��1������к͵ζ�ʱ���ζ���ʼ�͵ζ��յ��ĵζ��ٶȿ��Կ�һЩ���ӽ��ζ��յ��ٶ�Ҫ������ֹ�ζ����������Դ��ǣ��ζ��յ�ζ��յ㣻��2�����ȡ���̪�ı�ɫ��Χ�ֱ���pH��3.1��4.4��8.2��10֮�䣬A��pH��Χʹ�õ�ָʾ���Ƿ�̪��C��pH��Χʹ�õ�ָʾ���Ǽ��ȣ��ζ��յ�ʱ����Һ��pHΪ7��B���ǵζ��յ㣻�ӽ��ζ��յ�ʱ��pH����ͻ�䣻���Դ��ǣ���̪�����ȣ��ζ��յ㣻pHͻ�䷶Χ����3����20.0mLA��Һ��10.0mLB��Һ��Ӧ��Ļ��Һ�У�n��H+��=0.01L��0.100molL��1��0.02L��0.01molL��1=8��10��4mol����ȡ��3.00mL�����Һ�����е�n��H+����=8��10��5mol��
1��A��Һ�е�n��OH����=0.05��10��3L��0.0100molL��1=5��10��7mol��
n��H+���䣾n��OH������������Һ�����ԣ�������ɫ��
���Դ��ǣ���ɫ��
�����㾫�������ڱ��⿼�������к͵ζ�����Ҫ�˽��к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ���ܵó���ȷ�𰸣�

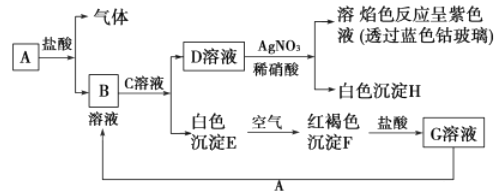
����Ŀ���Ȼ���ͭ��CuCl���������л��ϳɹ�ҵ�еĴ������ڿ�����Ѹ�ٱ���������ɫ��������ֽ⣬��ɺ�ɫ����ͼ�ǹ�ҵ��������ӡˢ��·�ķ�Һ����Fe3+��Cu2+��Fe2+��Cl��������CuCl�����̣� 
����������Ϣ�ش��������⣺
��1������������X�Ļ�ѧʽΪ ��
��2��д������CuCl�Ļ�ѧ����ʽ�� ��
��3����CuCl�����ɹ����������ϲ���Ҫ����SO2���壬��ϻ�ѧ����ʽ�ͱ�Ҫ������˵������ �� ʵ��������SO2Ҫ�ʵ�������ԭ�����������һ�㼴�ɣ���
��4��ʵ��̽��pH��CuCl���ʵ�Ӱ�����±���ʾ��
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl����/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
����CuCl�������pHΪ �� ��pH�ϴ�ʱCuCl���ʱ��ԭ���� �� ����pHʱ������ܡ����ܡ�������ͬpH������������ᣬ������ ��
��5���Ȼ���ͭ�Ķ��������� �ٳ�ȡ��Ʒ0.25g������FeCl3��Һ����ƿ�У�����ܽ⣮
����0.10molL��1���������Һ�ζ�����֪��CuCl+FeCl3�TCuCl2+FeCl2��Fe2++Ce4+�TFe3++Ce3+ �� ����ƽ��ʵ�������£�ƽ��ʵ�������ܳ���1%����
ƽ��ʵ����� | 1 | 2 | 3 |
0.25g��Ʒ�������������Һ�������mL�� | 24.35 | 24.05 | 23.95 |
����Ʒ��CuCl�Ĵ���Ϊ�����������λ��Ч���֣���