题目内容
【题目】X、Y、Z、W、E、F、G七种元素为周期表中原子序数依次增大的前四周期元素。6X的一种核素能用于测定文物的年代;Y元素最高价氧化物对应水化物能与其常见氢化物反应生成盐M;Z原子核外成对电子数是未成对电子数的3倍;W的原子半径在同周期主族元素中最大;E的基态原子的所有电子位于四个能级且每个能级均全充满;F的电负性在同周期中最大;G的基态原子N层只有一个电子,内层电子全部排满。请回等下列问题: (用X、Y、Z、W、E、F、G所对应的元素符号表示)
(1)写山F的基态原子的核外电子排布式:______________。
(2)Y、Z、W的电负性由大到小的顺序为_____________。
(3)以下可以表示X的基态原子的原子轨道表示式的是____________。
A. ![]() B.
B. ![]() C.
C. ![]()
(4)下图可以表示F的氢化物中电子云重叠方式的是_______。
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(5)基态E原子核外存在_____种运动状态不同的电子。
(6)G元素位于周期表中的_____区,基态原子价电子排布式为________。
【答案】 1s22s22p63s23p5或[Ne]3s23p5 O>N>Na A B 12 ds 3d104s1
【解析】考查位构性的应用,X的一种核素能用于测定文物的年代,即X为C,Y元素最高价氧化物对应水化物能与其常见的氢化物反应生成盐,即Y为N,Z原子核外成对电子数是未成对电子数的3倍,则Z为O,W的原子半径在同周期主族元素中最大的,即W为Na,E的基态原子的所用电子位于四个能级,且每个能级均全充满,则E为Mg,F的电负性在同周期中大,因为原子序数依次增大,则F为Cl,G的基态原子N层只有一个电子,内层电子全部排满,则G为Cu,(1)F为Cl,其基态原子的核外电子排布式为1s22s22p63s23p5或[Ne]3s23p5 ;(2)非金属性越强,其电负性越大,即电负性由大到小的顺序是O>N>Na;(3)根据泡利不相容原理,每个轨道最多容纳两个电子,且自旋方向相反,根据洪特规则,电子填充原子轨道,电子优先单独占据一个轨道,且自旋方向相同,故A正确;(4)F的氢化物是HCl,形成共价键类型为s-p,故B正确;(5)E核外有12个电子,核外有12种运动状态不同的电子;(6)G为Cu,位于第四周期IB族,属于ds区,价电子包括最外层电子和次外层d能级上的电子,Cu价电子排布式为3d104s1。

【题目】某学习小组为了探究原电池反应,做了如下实验:将Al片和Zn片插入到Na2SO4溶液中,装置如下图。
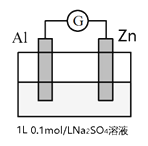
操作 | 现象 |
i接通电流计 | 接通开始之后指针向右偏且稳定;两极附近均没有明显现象。 |
ii向溶液中加入50mL 2mol/L H2SO4 | 开始时指针仍向右偏,Al、Zn表面均产生少量气泡;大约半分钟后,指针向左偏且稳定,Al、Zn表面均产生大量气泡。 |
下列说法不正确的是
A. i中指针向右偏时,Al的电极反应为:O2 + 4e- +2H2O = 4OH-
B. ii中开始时, Zn做负极,SO42-向Zn极移动
C. ii中半分钟后,装置中的反应为Al的析氢腐蚀和Al的化学腐蚀共存
D. 从上述实验中可以得出,Al在H2SO4中的还原性强于在Na2SO4中