题目内容
【题目】实验室欲用NaOH固体配制1.0 molL-1的NaOH溶液240 mL,根据溶液的配制情况回答下列问题:
(1)实验中除了用到托盘天平、药匙、量筒、烧杯外,还需用到的仪器有________。
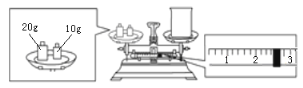
(2)通过计算可知,该实验需要称量NaOH_____g;某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如下图所示,则烧杯的实际质量为___g。
(3)使用容量瓶前必须进行的一步操作是________。
(4)在配制过程中,下列操作会使溶液浓度偏大的是_____(填序号)。
A.转移溶液时不慎有少量洒到容量瓶外面
B.定容时俯视刻度线
C.未冷却到室温就将溶液转移到容量瓶并定容
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
【答案】玻璃棒、250mL容量瓶、胶头滴管 10.0 27.4 检查容量瓶是否漏水 BC
【解析】
(1)根据实验操作的步骤以及每步操作需要仪器确定实验所需仪器;
(2)根据天平的称量原理;根据m=nM=cVM计算溶质NaOH的质量;
(3)使用容量瓶前必须进行的一步操作是检漏;
(4)根据c=n/V分析操作对溶质的物质的量或对溶液的体积的影响判断。
(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,故答案为:玻璃棒、250mL容量瓶、胶头滴管;
(2)因配制溶液的体积为240ml,而容量瓶的规格没有240mL,只能选用250mL,NaOH的质量m=cVM=1.0molL-1×0.25L×40g/mol=10.0g,因天平的称量原理为左盘物体的质量=右盘物体的质量+游码的读数,所以烧杯的实际质量为27.4g,故答案为:10.0;27.4;
(3)因使用容量瓶前必须进行的一步操作是检查容量瓶是否漏水,故答案为:检查容量瓶是否漏水;
(4)A项、转移溶液时不慎有少量洒到容量瓶外面,溶质的质量减少,浓度偏小,故A错误;B项、定容时俯视刻度线,溶液的体积偏小,浓度偏高,故B正确;C项、未冷却到室温就将溶液转移到容量瓶并定容,冷却下来溶液的体积偏小,浓度偏高,故C正确;D项、定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,溶液的体积偏大,浓度偏小,故D错误,故选BC,故答案为:BC。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
【题目】碳、氮及其化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)汽车尾气中的处理NO的方法也可用H2将NO还原为N2。
已知: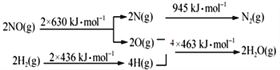
H2还原NO生成氮气和水蒸气的热化学方程是_______________________________。
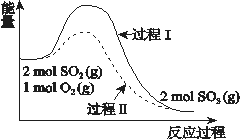
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,利用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的一种新举措,反应原理为CO(g)+2H2(g)![]() CH3OH(g) ΔH。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH 的体积分数在不同压强下随温度的变化如图。
CH3OH(g) ΔH。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH 的体积分数在不同压强下随温度的变化如图。
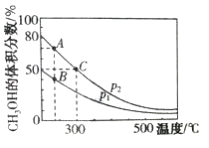
①上述合成甲醇的反应是__________________(填“吸热”或“放热”)反应,图像中的压强p1、p2的大小关系是_______________,判断的理由是________________________。
②从上图A、B、C三点中选填下表物理量对应最大的点(用“A”、“B”或“C”填写)。
反应速率V | 平衡常数K | 平衡转化率a |
____________ | _____________ | _____________ |
③在300℃时,向C点平衡体系中再充入0.25molCO、0.5molH2和0.25molCH3OH。该平衡_________(填“向正反应方向”、“向逆反应方向”或“不”)移动。
(3)有利于提高CO平衡转化率的措施有_________________。
A.使用催化剂 B.投料比不变,增加CO的浓度
C.降低反应温度 D.通入He气体使体系的压强增大
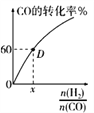
(4)一定温度下,CO的转化率与起始投料比![]() 的变化关系如图所示,测得D点氢气的转化率为40%,则x=__________________。
的变化关系如图所示,测得D点氢气的转化率为40%,则x=__________________。