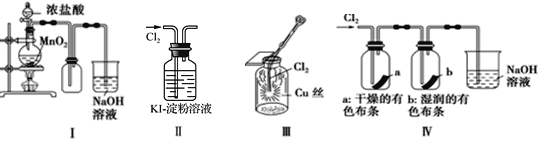
��Ŀ����
����Ŀ��ijѧϰС��Ϊ��̽��ԭ��ط�Ӧ����������ʵ�飺��AlƬ��ZnƬ���뵽Na2SO4��Һ�У�װ������ͼ��
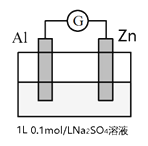
���� | ���� |
i��ͨ������ | ��ͨ��ʼ֮��ָ������ƫ���ȶ�������������û���������� |
ii����Һ�м���50mL 2mol/L H2SO4 | ��ʼʱָ��������ƫ��Al��Zn����������������ݣ���Լ����Ӻ�ָ������ƫ���ȶ���Al��Zn����������������ݡ� |
����˵������ȷ����
A. i��ָ������ƫʱ��Al�ĵ缫��ӦΪ��O2 + 4e- +2H2O = 4OH-
B. ii�п�ʼʱ�� Zn��������SO42-��Zn���ƶ�
C. ii�а���Ӻ�װ���еķ�ӦΪAl�����ⸯʴ��Al�Ļ�ѧ��ʴ����
D. ������ʵ���п��Եó���Al��H2SO4�еĻ�ԭ��ǿ����Na2SO4��
���𰸡�D
��������A. i��ָ������ƫʱ��AlΪ�����������õ��Ӳ������������ӣ��缫��ӦΪ��O2 + 4e- +2H2O = 4OH-��ѡ��A��ȷ��B. ii�п�ʼʱ����ʼʱָ��������ƫ�� Zn��������������SO42-�� Zn���ƶ���ѡ��B��ȷ��C. ii�а���Ӻ�ָ������ƫ���ȶ�����Ϊ������������ʧ���ӣ����������ӵõ��Ӳ�����������װ���еķ�ӦΪAl�����ⸯʴ��Al�Ļ�ѧ��ʴ���棬ѡ��C��ȷ��D. ������ʵ���п��Եó���Al�Ļ�ԭ�Զ�ǿ��п��ֻi�����������������Ϊ��ص���������ii���������������ᷴӦ�����γɸ�����ѡ��D����ȷ��