题目内容
11.下列说法或表示方法正确的是( )| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(石墨)=C(金刚石)△H=+11.9 kJ/mol,可知金刚石比石墨稳定 | |
| C. | 水力(水能)按不同的分类可看成可再生能源和一级能源 | |
| D. | 可表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ/mol |
分析 A、硫蒸气变化为硫固体为放热过程;
B、物质的能量越低越稳定;
C、水能是自然界中以现成形式提供的能源,可以从自然界补充;
D、氢气燃烧生成稳定的化合物为液体水.
解答 解:A、硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,即前者放出热量多,故A错误;
B、石墨能量比金刚石低,石墨稳定,故B错误;
C、水能是自然界中以现成形式提供的能源,为一级能源,可以从自然界补充属于可再生能源,故C正确;
D、氢气燃烧生成稳定的化合物为液体水,所以H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ/mol不能表示氢气燃烧热的热化学方程式,故D错误;
故选C.
点评 本题考查了化学反应中的能量变化,燃烧热、能源的分类,属于基础知识的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 1 mol聚乙烯含有的原子数目为6NA | |
| B. | 标况下1 L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA/22.4 | |
| C. | 1 mol甲基含7 NA个电子 | |
| D. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
2.现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)A基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形.
(2)某同学根据上述信息,所画的B电子排布图如图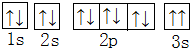 ,违背了泡利原理.
,违背了泡利原理.
(3)F位于周期表中第四周期、ⅦB族、d区,其基态原子有25种运动状态.
(4)CD3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验E元素的方法是焰色反应.
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
(2)某同学根据上述信息,所画的B电子排布图如图
 ,违背了泡利原理.
,违背了泡利原理.(3)F位于周期表中第四周期、ⅦB族、d区,其基态原子有25种运动状态.
(4)CD3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形,检验E元素的方法是焰色反应.
19.CoCl2•xH2O在加热时会逐步失水,并呈现不同的颜色,实验室里可以制成变色硅胶,用以干燥并验证水份.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种新工艺流程如图:
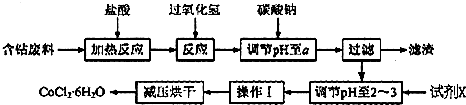
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl═CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
请回答下列问题:
(1)写出加入过氧化氢时溶液中发生的离子反应方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;
(3)最合适的试剂X是盐酸
(4)操作I包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和减压过滤.
(5)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl═CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴.
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Co(OH)3 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.6 | 3.4 |
| 完全沉淀 | 4.1 | 9.2 | 5.2 |
(1)写出加入过氧化氢时溶液中发生的离子反应方程式:2Fe2++H2O2+2H+=2Fe3++2H2O
(2)加入碳酸钠调节pH至a,a的范围是5.2~7.6;
(3)最合适的试剂X是盐酸
(4)操作I包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和减压过滤.
(5)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
6.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 30g乙烷含有的共价键数目为8NA | |
| B. | 标况下,22.4L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA | |
| C. | 1mol甲基含10 NA个电子 | |
| D. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
16.标准状况下质量为4g H2的体积约为( )
| A. | 11.2 L | B. | 22.4 L | C. | 33.6 L | D. | 44.8 L |
20.有机化合物M的结构简式如图所示,有关化合物M的叙述正确的是( )
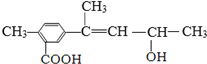
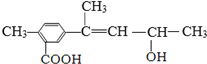
| A. | M的分子式为C13H18O3 | |
| B. | M一定条件下,可以发生加成、酯化、水解等反应 | |
| C. | 1mol M与足量金属钠反应,可生成标准状况下的H211.2 L | |
| D. | 1mol M最多能与4mol H2发生加成反应 |