题目内容
3.现有浓度均为0.1mol•L-1的盐酸、硫酸、醋酸三种溶液,回答下列问题:(1)若三种溶液中c(H+)分别为a1mol•L-1、a2mol•L-1、a3mol•L-1,则它们的大小关系为$\frac{1}{2}$a1=a2>a3.
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,若生成盐的物质的量依次为b1mol、b2mol、b3mol,则它们的大小关系为b1=b2=b3.
(3)分别用以上三种酸中和等物质的量的NaOH溶液生成正盐,则需要体积最少的酸为H2SO4(填化学式).
(4)分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为v2>v1>v3.
分析 (1)盐酸是一元强酸,硫酸是二元强酸,都能够完全电离,醋酸是一元弱酸,不能完全电离,据此分析;
(2)等体积的浓度均为0.1mol•L-1的盐酸、硫酸、醋酸三种溶液,所含酸根的物质的量相同;
(3)硫酸为二元酸,盐酸与醋酸为一元酸,据此分析;
(4)生成氢气速率的大小决定于氢离子浓度的大小.
解答 解:(1)盐酸是一元强酸,硫酸是二元强酸,都能够完全电离,醋酸是一元弱酸,不能完全电离,所以浓度均为0.1mol•L-1的盐酸、硫酸、醋酸三种溶液中,氢离子浓度分别为0.1mol•L-1、0.2mol•L-1、小于0.1mol•L-1,所以$\frac{1}{2}$a1=a2>a3,故答案为:$\frac{1}{2}$a1=a2>a3;
(2)等体积的浓度均为0.1mol•L-1的盐酸、硫酸、醋酸三种溶液,所含酸根的物质的量相同,所以其与NaOH反应生成盐的物质的量相同,故答案为:b1=b2=b3;
(3)硫酸为二元酸,盐酸与醋酸为一元酸,分别用以上三种相同浓度的酸中和等物质的童的NaOH溶液生成正盐,则需要体积最少的酸为二元酸硫酸,
故答案为:H2SO4;
(4)浓度均为0.1mol•L-1的盐酸、硫酸、醋酸三种溶液,氢离子浓度分别为0.1mol•L-1、0.2mol•L-1、小于0.1mol•L-1,生成氢气速率的大小决定于氢离子浓度的大小,所以分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为v2>v1>v3,故答案为:v2>v1>v3.
点评 本题考查了酸碱中和、弱电解质的电离、影响化学反应速率的因素等,题目综合性较强,难度中等.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
13.下列实验能获得成功的是( )
| A. | 用溴水可鉴别苯、乙醇、苯乙烯(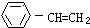 ) ) | |
| B. | 加浓溴水,然后过滤可除去苯中的少量乙烯 | |
| C. | 苯、溴水、铁粉混合制取溴苯 | |
| D. | 可用分液漏斗分离硝基苯和苯 |
14.不能正确表示下列反应的离子方程式是( )
| A. | Na与稀硫酸反应的离子方程式为2Na+2H+═2Na++H2↑ | |
| B. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀 Ca2++HCO3-+OHˉ═CaCO3↓+H2O | |
| D. | 饱和碳酸钠溶液中通入过量二氧化碳气体 CO32-+CO2+H2O═HCO3- |
11.下列说法或表示方法正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(石墨)=C(金刚石)△H=+11.9 kJ/mol,可知金刚石比石墨稳定 | |
| C. | 水力(水能)按不同的分类可看成可再生能源和一级能源 | |
| D. | 可表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ/mol |
18.下列对化学知识的认识正确的是( )
| A. | H2与T2互为同位素 | B. | 氯化钠、硫酸钡都属于强电解质 | ||
| C. | 离子化合物中可能含共价键 | D. | SO2、CO均属于酸性氧化物 |
8.在水溶液中能够大量共存的是( )
| A. | Na+、Fe2+、OH- | B. | Ag+、Cl-、NO3- | C. | NH4+、OH-、SO42- | D. | Na+、Cl-、NO3- |
15.某有机物的结构简式为:HO-CH2-CH═CH-COOH,现有①氯化氢、②溴水、③纯碱溶液、④乙醇、⑤酸性高锰酸钾溶液,试根据该有机物的结构特点,判断在一定条件下,能与其反应的物质是( )
| A. | 只有②④⑤ | B. | 只有①③④ | C. | 只有①②③⑤ | D. | ①②③④⑤ |
13.下列反应中反应物总能量高于生成物总能量的是( )
| A. | 氢氧化铁受热分解 | B. | 盐酸与镁条反应产生氢气 | ||
| C. | 二氧化碳与碳生成一氧化碳 | D. | 碳与水蒸气生成一氧化碳和氢气 |