题目内容
1.下列说法正确的是(NA表示阿伏加德罗常数的值)( )| A. | 1 mol聚乙烯含有的原子数目为6NA | |
| B. | 标况下1 L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA/22.4 | |
| C. | 1 mol甲基含7 NA个电子 | |
| D. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
分析 A、聚乙烯是高分子化合物,聚合度不确定;
B、标况下,己烷为液态;
C、甲基不带电荷;
D、乙烯和丙烯的最简式均为CH2.
解答 解:A、聚乙烯是高分子化合物,聚合度不知道,无法计算原子数目,故A错误;
B、标况下,己烷为液态,不能根据气体摩尔体积来计算其物质的量,故B错误;
C、甲基不带电荷,1mol甲基含9mol电子即9NA个,故C错误;
D、乙烯和丙烯的最简式均为CH2,故2.8g混合物中含有的CH2的物质的量n=$\frac{2.8g}{14g/mol}$=0.2mol,故含有的碳原子的个数为0.2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.下列化学实验事实及其解释不正确的是( )
| A. | Na2CO3能电离出CO32-,可用澄清石灰水鉴别Na2CO3和NaHCO3溶液 | |
| B. | 钠保存在煤油中,是因为煤油不与钠反应,且钠比煤油密度大、煤油可以隔绝空气 | |
| C. | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 | |
| D. | 钠长期暴露在空气中的产物是Na2CO3,原因是钠在空气中生成的Na2O会与水和二氧化碳反应 |
4.下列实验操作及结论正确的是( )
| A. | 钠与乙醇反应的现象与钠与水反应的现象相同 | |
| B. | 在淀粉溶液中加入20%的稀硫酸水解后,立即加入新制Cu(OH)2悬浊液共热,证明有葡萄糖生成 | |
| C. | 在CuSO4溶液中加入过量NaOH溶液振荡,立即加入麦芽糖溶液并加热,能证明麦芽糖具有还原性 | |
| D. | 在乙醇溶液中插入一根红热的铜丝,能证明醇氧化成醛 |
11.氟利昂-12的化学式是CCl2F2,下列叙述不正确的是( )
| A. | 该分子是平面结构 | B. | 该分子是正四面体型 | ||
| C. | 该分子无同分异构体 | D. | 该物质属于卤代烃 |
13.下列实验能获得成功的是( )
| A. | 用溴水可鉴别苯、乙醇、苯乙烯(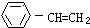 ) ) | |
| B. | 加浓溴水,然后过滤可除去苯中的少量乙烯 | |
| C. | 苯、溴水、铁粉混合制取溴苯 | |
| D. | 可用分液漏斗分离硝基苯和苯 |
11.下列说法或表示方法正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(石墨)=C(金刚石)△H=+11.9 kJ/mol,可知金刚石比石墨稳定 | |
| C. | 水力(水能)按不同的分类可看成可再生能源和一级能源 | |
| D. | 可表示氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8 kJ/mol |
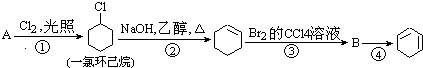
 ,名称是环己烷
,名称是环己烷
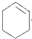 具有的性质叙述正确的是C、D
具有的性质叙述正确的是C、D
