题目内容
17.写出碳酸钙与盐酸反应的离子方程CaCO3+2H+═Ca2++CO2↑+H2O.分析 碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,沉淀、气体、弱电解质都要写化学式,据此分析解答.
解答 解:碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,沉淀、气体、弱电解质都要写化学式,所以该反应离子方程式为CaCO3+2H+═Ca2++CO2↑+H2O,故答案为:CaCO3+2H+═Ca2++CO2↑+H2O.
点评 本题考查离子方程式的书写,为高频考点,明确离子性质及离子方程式书写规则是解本题关键,注意要遵循原子守恒、客观守恒、电荷守恒,题目难度不大.

练习册系列答案
相关题目
7.素有世界“雾都”之称的英国伦敦,每当春秋之交,经常被浓雾所笼罩.弥漫的大雾不仅影响交通,酿成事故,还直接危害人们的健康.下列关于大雾的说法正确的是( )
| A. | 大雾是一种纯净物 | |
| B. | 大雾是一种分散质微粒直径大于100 nm 的分散系 | |
| C. | 光束通过大雾时会产生一条光亮的通路 | |
| D. | 大雾实际上是水蒸气 |
5.下列物质属于天然高分子化合物的是( )
| A. | 淀粉 | B. | 蔗糖 | C. | 油脂 | D. | 葡萄糖 |
12.分离碘水溶液的方法正确的是( )
| A. | 蒸馏 | B. | 萃取和分液 | C. | 过滤 | D. | 分液 |
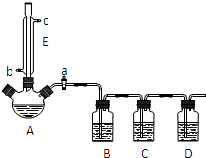 某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物.且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃.
某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物.且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃.