题目内容
18.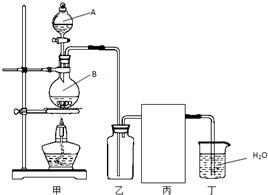 (1)实验室制备HCl气体的反应为:
(1)实验室制备HCl气体的反应为:2NaCl(固体)+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+2HCl↑利用以下装置来制备并收集HCl气体,并进行尾气吸收,请回答:①仪器A的名称为分液漏斗.
②装置丙中的仪器有广口瓶、双孔塞、必要的玻璃导管和橡胶导管,请在答题卡的指定位置画出丙中的仪器图.
③连接好装置后,关闭分液漏斗活塞,将导管插入水中,用热毛巾敷圆底烧瓶,导管口出现气泡,松开热毛巾,导管内形成一段水柱,且一段时间不变化,则气密性良好.
④不要装置甲中的酒精灯,也可以制备少量HCl气体,则A和B中的试剂可以换成浓盐酸,浓硫酸.
(2)实验室可以通过氧化还原滴定的方法用已知浓度的KMnO4溶液来测量未知浓度的
草酸溶液,反应为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
操作为:用锥形瓶盛装20.00mL 未知浓度的草酸溶液,用酸式滴定管装0.1000mol/L KMnO4溶液进行滴定,记录滴定前和滴定后的体积,再重复操作2次.
请回答:
①当滴入最后一滴KMnO4溶液,锥形瓶内溶液溶液恰好由无色变成浅紫红色,且半分钟不变化,
则说明达到滴定终点.
②设计表格,记录有关数据,请在下表格中补充栏目,把表格设计完整,(需记录的待测物理量和所拟定的数据;数据用字母a、b、c等来表示)
| 实验 次数 | 草酸溶液的体积 (mL) | ||
| 1 | 20.00 | ||
分析 (1)①熟悉仪器的形状及用途,说出其名称;
②氯化氢易溶于水,所以应加入防止倒吸装置;
③检验装置的气密性,应先在装置中形成封闭体系;
④浓盐酸易挥发,浓硫酸具有吸水性,溶于水放出大量的热有利于氯化氢的挥发;
(2)①高锰酸钾溶液颜色为紫红色,滴定终点时,溶液由无色变为红色,不用指示剂,当最后一滴溶液滴入,溶液的紫色退去,且30s内不复现,可达到滴定终点;
②氧化还原滴定法测定物质浓度,应测量的数据为反应消耗的高锰酸钾的体积,应读取的数据有滴定前读数,滴定后读数,据此算成消耗高锰酸钾的体积,为求实验的准确性,应测3次然后取平均值计算;
③设草酸溶液的浓度为c,根据关系式2KMnO4~5H2C2O4计算.
解答 解:(1)①图中A为分液漏斗,用来盛放液态反应物;
故答案为:分液漏斗;
②氯化氢易溶于水,为防止倒吸发生,丙应是防倒吸用的安全瓶,装置图为: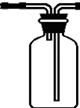 或者
或者 ;
;
故答案为: 或者
或者 ;
;
③检验装置的气密性,应先在装置中形成封闭体系,所以正确操作为:关闭分液漏斗活塞,把导管插入水中;
故答案为:关闭分液漏斗活塞,把导管插入水中;
④浓盐酸易挥发,浓硫酸具有吸水性,溶于水放出大量的热有利于氯化氢的挥发,向浓硫酸中滴加浓盐酸,不需要加热就能产生氯化氢,
故答案为:浓盐酸和浓硫酸;
(2)①高锰酸钾溶液颜色为紫红色,滴定终点时,溶液由无色变为红色,所以溶液恰好由无色变成浅紫红色,且半分钟不变化,达到滴定终点;
故答案为:溶液恰好由无色变成浅紫红色,且半分钟不变化;
②实验过程中应该测量的数据为滴定前滴定管的读数,滴定后滴定管的读数,测量3次,
数据表格如下:
| 实验 次数 | 草酸溶液的体积 (mL) | KMnO4溶液的体积 | ||
| 滴定前读数(mL) | 滴定后读数(mL) | KMnO4溶液体积(mL) | ||
| 1 | 20.00 | a | b | b-a |
| 2 | 20.00 | c | d | d-c |
| 3 | 20.00 | e | f | f-e |
故答案为:
| 实验 次数 | 草酸溶液的体积 (mL) | KMnO4溶液的体积 | ||
| 滴定前读数(mL) | 滴定后读数(mL) | KMnO4溶液体积(mL) | ||
| 1 | 20.00 | a | b | b-a |
| 2 | 20.00 | c | d | d-c |
| 3 | 20.00 | e | f | f-e |
2KMnO4 ~5H2C2O4
2mol 5mol
0.0022mol c×0.0200L
解得C=0.2750mol/L
故答案为:0.2750.
点评 本题为实验题,考查了实验室制备氯化氢、氧化还原滴定法测定物质的浓度,明确物质的性质和滴定法测定物质浓度的步骤及注意事项是解题关键,注意有效数字的保留.

| 相关实验 | 预期目的 | |
| A | 将SO2通入溴水,溴水褪色 | 验证SO2的还原性 |
| B | 将氯水加入淀粉KI溶液中 | 验证Cl非金属性比I强 |
| C | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| D | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在溶剂中提高苯的比例,能提高溶液的导电性 | |
| B. | 电解时阳极的电极反应式为2Br--2e-=Br2 | |
| C. | 电解时可用铁作阳极材料 | |
| D. | 汽油样品应加在阴极区 |
| A. | 石英 | B. | C60 | C. | NaCl | D. | 金属K |
| A. | 分馏 | B. | 干馏 | C. | 裂化 | D. | 裂解 |
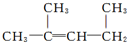 的名称:1,3-二甲基-2丁烯( )
的名称:1,3-二甲基-2丁烯( )