题目内容
【题目】已知物质A~I之间的转化关系符合下图所示.其中A、C、F、G、I为常见固体且焰色反应均为黄色;A为海水中主要溶质,B为常温下常见液体;E为黄绿色气体,H是无色无味且能使澄清石灰水变浑浊的气体.
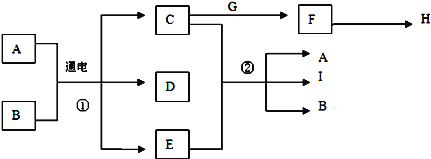
试回答下列问题:
(1)D的化学式为__________。
(2)反应①的化学方程式为:____________________________。
(3)反应②的离子方程式为:____________________________。
(4)写出镁条在H气体中燃烧的反应方程式为:___________________________。
(5)G在水中的电离方程式_____________________________。
(6)在A、I和B的混合物中加入稀硫酸,有黄绿色气体产生,写出该反应的化学方程式_____。
【答案】H2 2NaCl+ 2H2O ![]() H2↑ + Cl2↑ + 2NaOH Cl2 + 2OH- == Cl- + ClO- + H2O 2Mg +CO2
H2↑ + Cl2↑ + 2NaOH Cl2 + 2OH- == Cl- + ClO- + H2O 2Mg +CO2![]() 2MgO+C NaHCO3 = Na+ +HCO3- NaCl+NaClO+H2SO4== Cl2↑+ Na2SO4+ H2O
2MgO+C NaHCO3 = Na+ +HCO3- NaCl+NaClO+H2SO4== Cl2↑+ Na2SO4+ H2O
【解析】
A、C、F、G、I为常见固体且焰色反应均为黄色,说明均有钠元素,A为海水中主要溶质,则A为NaCl,B为常温下常见液体,则B为H2O;E为黄绿色气体,则E为Cl2,H是无色无味且能使澄清石灰水变浑浊的气体,则H为CO2,根据题中各物质转化关系,电解食盐水得C、D、E,C中含有钠元素,则C为NaOH,则D为H2,C与E反应生成A、I、B,则I为NaClO,C、F、G均含有钠元素,F能产生二氧化碳,则G为NaHCO3,F为Na2CO3。(1)D的化学式为H2;(2)反应①的化学方程式为:2NaCl+ 2H2O ![]() H2↑ + Cl2↑ + 2NaOH;(3)反应②的离子方程式为:Cl2 + 2OH- == Cl- + ClO- + H2O;(4)镁条在CO2气体中燃烧的反应方程式为:2Mg +CO2
H2↑ + Cl2↑ + 2NaOH;(3)反应②的离子方程式为:Cl2 + 2OH- == Cl- + ClO- + H2O;(4)镁条在CO2气体中燃烧的反应方程式为:2Mg +CO2![]() 2MgO+C;(5)G为NaHCO3,在水中的电离方程式为:NaHCO3 = Na+ +HCO3-;(6)在A、I和B的混合物中加入稀硫酸,有黄绿色气体产生,反应的化学方程式为:NaCl+NaClO+H2SO4== Cl2↑+ Na2SO4+ H2O。
2MgO+C;(5)G为NaHCO3,在水中的电离方程式为:NaHCO3 = Na+ +HCO3-;(6)在A、I和B的混合物中加入稀硫酸,有黄绿色气体产生,反应的化学方程式为:NaCl+NaClO+H2SO4== Cl2↑+ Na2SO4+ H2O。