题目内容
【题目】(1)配平下列离子方程式:______
Ce3++ H2O2+ H2O === Ce(OH)4↓+_______H+
(2)已知某待测液由Ag+、Mg2+、K+、Ba2+、NH4+、NO3-中的若干种离子组成,进行如下实验:
第一步:加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,逐渐滴入NaOH溶液至溶液呈碱性,在此过程中没有沉淀和气体产生,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
①写出第三步加热该溶液后,有气体生成的反应的离子方程式:_________________;
②待测液中一定含有_______和NO3-离子,一定不含有_________离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称)___________。
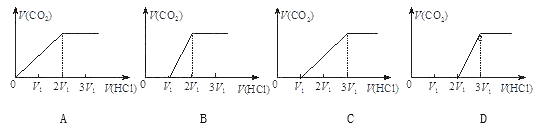
③往含等物质的量CO32-和HCO3-的溶液中滴入HCl溶液,下列表示产生的气体在标准状况下的体积与加入的HCl溶液体积关系图正确的是_________。
【答案】2,1,6==2,6 NH4++OH-![]() NH3↑+H2O Ag+、Ba2+、NH4+ Mg2+ 焰色反应 C
NH3↑+H2O Ag+、Ba2+、NH4+ Mg2+ 焰色反应 C
【解析】
(1)反应中Ce3+中Ce元素由+3价变为+4价,升高1,H2O2中氧元素由-1价降为-2价,降低1×2,最小公倍数为2,Ce3+、Ce(OH)4配2,H2O2配1,再结合质量守恒和电荷守恒配平得反应:2Ce3++H2O2+6H2O = 2Ce(OH)4↓+6H+,故答案为:2,1,6==2,6;(2)第一步:加入过量的稀盐酸,有白色沉淀生成,沉淀为AgCl,则一定含有Ag+;第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成,沉淀为硫酸钡,则一定含有Ba2+;第三步:再过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体,气体为氨气,说明一定含NH4+,一定没有Mg2+,①第三步加热该溶液后,有气体生成的反应的离子方程式为:NH4++OH-![]() NH3↑+H2O;②由上述分析可知,一定含有的阳离子为Ag+、Ba2+、NH4+,一定不含Mg2+,钾离子不能确定,可利用焰色反应来检验,方法为透过蓝色钴玻璃看是否呈紫色,呈紫色说明有K+,不呈紫色说明无K+;③由于CO32-与酸的反应是分步进行的:CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,开始是HCO3-离子不参加反应,只有CO32-反应,所以开始时没有二氧化碳气体生成,当CO32-完全生成HCO3-后,生成的HCO3-和原溶液中的HCO3-一起反应生成二氧化碳气体,反应前CO32-和HCO3-物质的量相等,设为nmol,则CO32-生成HCO3-消耗的氯化氢的物质的量为nmol,同时生成nmolHCO3-,溶液中此时总共含有2nmolHCO3-,完全反应生成二氧化碳,需要消耗氯化氢2nmol,即没有生成二氧化碳消耗盐酸的体积是生成二氧化碳消耗盐酸体积的一半,只有C符合,答案选C。
NH3↑+H2O;②由上述分析可知,一定含有的阳离子为Ag+、Ba2+、NH4+,一定不含Mg2+,钾离子不能确定,可利用焰色反应来检验,方法为透过蓝色钴玻璃看是否呈紫色,呈紫色说明有K+,不呈紫色说明无K+;③由于CO32-与酸的反应是分步进行的:CO32-+H+=HCO3-、HCO3-+H+=H2O+CO2↑,开始是HCO3-离子不参加反应,只有CO32-反应,所以开始时没有二氧化碳气体生成,当CO32-完全生成HCO3-后,生成的HCO3-和原溶液中的HCO3-一起反应生成二氧化碳气体,反应前CO32-和HCO3-物质的量相等,设为nmol,则CO32-生成HCO3-消耗的氯化氢的物质的量为nmol,同时生成nmolHCO3-,溶液中此时总共含有2nmolHCO3-,完全反应生成二氧化碳,需要消耗氯化氢2nmol,即没有生成二氧化碳消耗盐酸的体积是生成二氧化碳消耗盐酸体积的一半,只有C符合,答案选C。