��Ŀ����
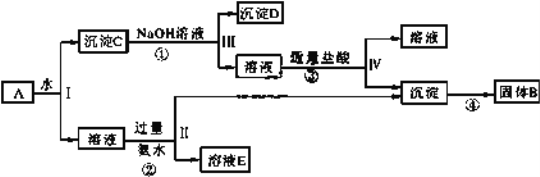
����Ŀ��������һƿ�������Һ�����п��ܺ���H+��NH4+��Mg2+��Ba2+��Al3+��I����NO3����CO32����SO42����AlO2����ȡ����Һ��������ʵ�飺
��1��ȡpH��ֽ���飬��Һ�����ԣ������ų�______________�Ĵ��ڣ�
��2��ȡ��������Һ����������CCl4������������ˮ������CCl4���Ϻ�ɫ�������ų�_______���ڣ�
��3����ȡ��������Һ����NaOH��Һ��ʹ��Һ��������Ϊ���ԣ���Ӧ�����о��������������ֿ��ų�____________�Ĵ��ڣ�
��4��ȡ����������������Һ��Na2CO3��Һ���а�ɫ�������ɣ�֤����_______�Ĵ��ڣ��ֿ����ų�__________�Ĵ��ڣ�
��5����������ʵ����ʵ����ȷ��������Һ�п϶����ڵ�������____________��������ȷ���Ƿ���ڵ�������_______________��
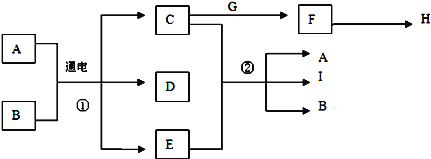
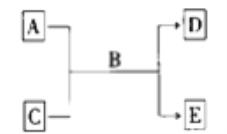
����ij����� A������ KAl(SO4)2��Al2O3 �� Fe2O3����һ�������¿�ʵ����ͼ��ʾ������֮��ı仯��
�ݴ˻ش��������⣺
��1�����IJ��ж�����Һ�ͳ����ķ����ȡ�ķ�����__________��
��2������������ͼ��Ӧ��ϵ��д������B��C��D �������ʵĻ�ѧʽ(��ʾ����Ϊ�����)��
���� B_________������ C__________������ D _________��
��3��д�������ڷ�Ӧ���ӷ���ʽ��
��___________________________________________��
��___________________________________________��
��4������۽��Ѳ�������ν�ʵ�鷽�����иĽ���________________________��
���𰸡�CO32����AlO2�� NO3�� Mg2+��Al3+ Ba2+ SO42�� H+��I����Ba2+ NH4+ ���� Al2O3 Al2O3��Fe2O3 Fe2O3 Al2O3+ 2 OH-=2AlO2-+H2O Al3+��3NH3��H2O=Al(OH)3����3NH4+ ��NaAlO2��Һ��ͨ�������CO2��������ȫ���𰸺���������
��������
I�����⿼�����Ӽ�����棬��1����Һ�����ԣ�˵����Һ�к��д���H����H����CO32�����ܴ������棬H����AlO2�����ܴ������棬һ�����ܴ�����CO32����AlO2������2����������CCl4������������ˮ��CCl4�����Ϻ�ɫ��˵��ԭ��Һ��I����NO3�������������¾���ǿ�����ԣ��ܰ�I�����������ԭ��Һ��һ��û��NO3������3����ȡ������Һ������NaOH��Һ��ʹ��Һ��������Ϊ���ԣ���Ӧ�����о�������������ԭ��Һ�в���Mg2����Al3������4��ȡ��3������Һ������̼������Һ�����ְ�ɫ�������˳���ӦΪBaCO3��˵��ԭ��Һ�к���Ba2������ΪBa2����SO42����Ӧ���ɳ�������ԭ��Һ�в���SO42������5����������������һ�����е�������H����I����Ba2��������ȷ����������NH4����II.��1����������ͼ���IJ�������Һ�ͳɵ�ķ��뷽���ǹ��ˣ���2��Al2O3��Fe2O3������ˮ��KAl(SO4)2����ˮ���Ƴ�����CΪAl2O3��Fe2O3������C�м���NaOH��Һ����Ϊ������Ϊ���������������Ϊ���������������Al2O3��2OH��=2AlO2����H2O�������DΪFe2O3����Ӧ�ڷ���Al3����3NH3��H2O=Al(OH)3����3NH4������Ӧ��ΪAl2O3��2OH��=2AlO2����H2O����Ӧ��ΪAlO2����H����H2O=Al(OH)3������Ӧ�����������ֽ����������������BΪAl2O3����3������������������Ӧ�ٵ����ӷ���ʽΪAl2O3+ 2 OH-=2AlO2-+H2O����Ӧ�ڵ����ӷ���ʽΪ Al3����3NH3��H2O=Al(OH)3����3NH4������4����������Ϊ���ԣ�����������������Al(OH)3��3H��=Al3����3H2O���Ľ���������NaAlO2��Һ��ͨ�������CO2��������ȫ��