题目内容
【题目】aLCO2气体通过足量Na2O2后,所得气体再与bLNO混合时,可得到cL气体(气体体积均在相同状况下测定),下列表达式中,错误的是( )
A. 若a则c<![]() (a+b) B. 若a则c>
(a+b) B. 若a则c>![]() (a+b)
(a+b)
C. 若a>b则c=![]() (a+b) D. 若a=b则c=
(a+b) D. 若a=b则c=![]() (a+b)
(a+b)
【答案】A
【解析】
aLCO2气体通过足量Na2O2后,发生反应:2Na2O2+2CO2=2Na2CO3+O2,可知生成氧气体积为0.5aL,所得气体与bLNO混合发生反应:O2+2NO=2NO2,二者恰好反应时0.5aL:b=1:2,则a=b,此时生成NO2体积c=2×0.5a=b=![]() (a+b);若a<b,则NO有剩余,由O2+2NO=2NO2可知气体体积减少0.5aL,故得到气体体积等于NO的体积,则c=b,c>
(a+b);若a<b,则NO有剩余,由O2+2NO=2NO2可知气体体积减少0.5aL,故得到气体体积等于NO的体积,则c=b,c>![]() (a+b);若a>b,则O2有剩余,由O2+2NO=2NO2可知气体体积减少量等于参加反应氧气的量,即气体体积减少0.5bL,故得到气体体积为(0.5aL+bL0.5bL)=
(a+b);若a>b,则O2有剩余,由O2+2NO=2NO2可知气体体积减少量等于参加反应氧气的量,即气体体积减少0.5bL,故得到气体体积为(0.5aL+bL0.5bL)=![]() (a+b),综上分析可知,A错误,BCD正确,故答案选A。
(a+b),综上分析可知,A错误,BCD正确,故答案选A。

【题目】氮化镁(Mg3N2)在工业上具有非常广泛的应用。某化学兴趣小组用镁与氮气反应制备 Mg3N2 并进行有关实验。实验装置如下所示: (部分加热装置已略去)
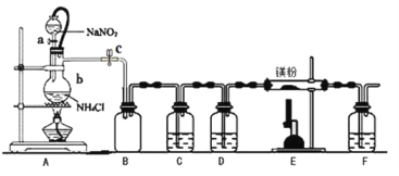
已知:①氮化镁常温下为浅黄色粉末,极易与水反应。
②亚硝酸钠和氯化铵制取氮气的反应剧烈放热,产生氮气的速度较快。
③温度较高时,亚硝酸钠会分解产生O2等。
回答下列问题:
(1)仪器 b 的名称是__________,写出装置 A 中发生反应的化学方程式___________。
(2)某同学检验装置 A 部分的气密性,关闭止水夹 c 后,开启活塞 a,水不断往下滴,直至全部流入烧瓶。试判断:
A 部分装置是否漏气? ________ (填“漏气”、“不漏气”或“无法确定”),判断理由是____________。
(3)装置 C 中为饱和硫酸亚铁溶液, 其作用是___________,装置 F 的作用是________。
(4)加热至反应开始发生,需移走 A 处酒精灯,原因是__________________。
(5)定性分析产物
操作步骤 | 实验现象 | 解释原因 |
取少量产品于试管中, 加适量蒸馏水 | 试管底部有固体不溶物,有剌激性气味的气体产生 | 反应的化学方程式为 __________________________________ |
弃去上层淸液, 加入足量稀盐酸 | 观察到固体全部溶解, 且有气泡冒出 | 气泡冒出的原因为___________________________________________________ |