题目内容
【题目】N2O、NO和NO2等氮氧化物是空气污染物含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为___。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为__。
①下列措施不能提高尾气中NO和NO2去除率的有____ (填字母代号)
A.采用气、液逆流的方式吸收尾气
B.加快通入尾气的速率
C.吸收尾气过程中定补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是____(填化学式),吸收后排放的尾气中含量较高的氮氧化物是____(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同, NO的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
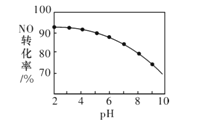
①在酸NaClO性溶液中,HC1O氧化NO生成Cl和NO3-,其离子方程式为3HClO+2NO+H2O=3C1-+2NO3-+5H+
②NaClO溶液的初始pH越小,NO转化率越高,其原因是_______。
【答案】2NH3+2O2![]() N2O+3H2O NO+NO2+2OH-=2NO2- +H2O、2NO2+2OH-=NO2- +NO3-+H2O B NaNO3 NO 溶液pH越小溶液中HClO的浓度越大氧化NO的能力越强
N2O+3H2O NO+NO2+2OH-=2NO2- +H2O、2NO2+2OH-=NO2- +NO3-+H2O B NaNO3 NO 溶液pH越小溶液中HClO的浓度越大氧化NO的能力越强
【解析】
依据氧化还原反应的规律结合元素守恒书写(1)、(2)问中的化学方程式;
(2)①从提高反应的转化率着手考虑;
②根据氢氧化钠吸收尾气后的产物分析作答;
(3)根据图像分析得出结论。
(1)NH3与O2在加热和催化剂作用下发生氧化还原反应生成N2O,根据得失电子守恒和原子守恒可知反应有水生成,配平化学方程式为:2NH3+2O2![]() N2O+3H2O;
N2O+3H2O;
(2)N2O的硝酸尾气中含NO2和NO,它们与NaOH溶液反应的离子方程式为:NO+NO2+2OH-=2NO2- +H2O、2NO2+2OH-=NO2- +NO3-+H2O;
①A. 采用气、液逆流的方式吸收尾气,可使气液充分接触,能提高尾气中NO和NO2的去除率,A项错误;
B. 加快通入尾气的速率,不能提高尾气中NO和NO2的去除率,B项正确;
C. 定期补充适量的NaOH溶液可增大反应物浓度,能提高尾气中NO和NO2的去除率,C项错误;
故答案为:B;
②由反应:NO+NO2+2OH-=2NO2-+H2O,2NO2+2OH-=NO2-+ NO3-+H2O可知,反应后得到NaNO2和NaNO3混合溶液,经浓缩、结晶、过滤得到NaNO2和NaNO3晶体,因此得到的NaNO2混有NaNO3;由反应可知,若NO和NO2的物质的量之比大于1:1,NO不能被吸收,因此,吸收后排放的尾气中含量较高的氮氧化物是NO;
(3)在相同条件下,ClO-在酸性条件下以HClO的形式存在,具有强氧化性,氧化剂的浓度越大,氧化能力越强,由反应2NO+3HClO+H2O=2NO3-+3Cl-+5H+可知,溶液pH越小,溶液中HClO浓度越大,氧化NO的能力越强。

 名校课堂系列答案
名校课堂系列答案


