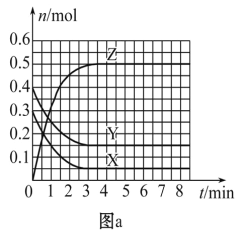
题目内容
【题目】下列叙述及解释正确的是
A. 2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. 对于C(s) + O2(g) ![]() 2CO(g) ,在平衡后,加入碳,平衡向正反应方向移动
2CO(g) ,在平衡后,加入碳,平衡向正反应方向移动
C. FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,平衡向逆方向移动
2NH3,平衡后,压强不变,充入O2,平衡向逆方向移动
【答案】D
【解析】
A. 对于2NO2(g)(红棕色)![]() N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,但是平衡移动使物质浓度减小的趋势是微弱的,总的来说物质的浓度比增大压强前增大,因此体系颜色变深,故A错误;
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,但是平衡移动使物质浓度减小的趋势是微弱的,总的来说物质的浓度比增大压强前增大,因此体系颜色变深,故A错误;
B. 对于C(s) + O2(g) ![]() 2CO(g) ,在平衡后,加入碳,由于碳的浓度为定值,对该平衡无影响,平衡不发生移动,故B错误;
2CO(g) ,在平衡后,加入碳,由于碳的浓度为定值,对该平衡无影响,平衡不发生移动,故B错误;
C. FeCl3+3KSCN![]() Fe(SCN)3(红色)+3KCl,该反应实质是:Fe3++3SCN-
Fe(SCN)3(红色)+3KCl,该反应实质是:Fe3++3SCN-![]() Fe(SCN)3,所以在平衡后,加少量KCl,没有影响反应体系的各种物质的浓度,所以平衡不发生移动,故体系颜色不变,故C错误;
Fe(SCN)3,所以在平衡后,加少量KCl,没有影响反应体系的各种物质的浓度,所以平衡不发生移动,故体系颜色不变,故C错误;
D. 对于N2+3H2![]() 2NH3,平衡后,压强不变,充入O2,则容器的容积增大,各种反应物的浓度减小,所以平衡左移,故D正确;
2NH3,平衡后,压强不变,充入O2,则容器的容积增大,各种反应物的浓度减小,所以平衡左移,故D正确;
综上所述,本题选D。

练习册系列答案
相关题目