题目内容
【题目】下列分子中,各分子的立体构型和中心原子的杂化方式均正确的是( )
A. NH3 平面三角形 sp3杂化 B. CCl4 正四面体 sp3杂化
C. H2O V形 sp2杂化 D. CO32﹣ 三角锥形 sp3杂化
【答案】B
【解析】
根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对数=配原子个数+孤电子对数。
A、NH3中心原子的价层电子对数=3+![]() (5-3×1)=4,N的杂化方式为sp3,含有一对孤电子对,分子的立体构型为三角锥形,选项A错误;
(5-3×1)=4,N的杂化方式为sp3,含有一对孤电子对,分子的立体构型为三角锥形,选项A错误;
B、CCl4中心原子的价层电子对数=4+![]() (4-4×1)=4,C的杂化方式为sp3,没有孤电子对,分子的立体构型为正四面体,选项B正确;
(4-4×1)=4,C的杂化方式为sp3,没有孤电子对,分子的立体构型为正四面体,选项B正确;
C、H2O中心原子的价层电子对数=2+![]() (6-2×1)=4,O的杂化方式为sp3,含有两对孤电子对,分子的立体构型为V形,选项C错误;
(6-2×1)=4,O的杂化方式为sp3,含有两对孤电子对,分子的立体构型为V形,选项C错误;
D、CO32- 中心原子的价层电子对数=3+![]() (4+2-3×2)=3,C的杂化方式为sp2,没有孤电子对,分子的立体构型为平面三角形,选项D错误;
(4+2-3×2)=3,C的杂化方式为sp2,没有孤电子对,分子的立体构型为平面三角形,选项D错误;
答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
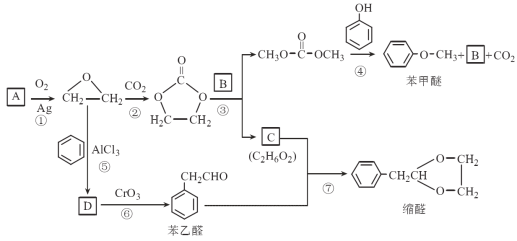
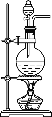
小学生10分钟应用题系列答案【题目】实验室制备1,2-二溴乙烷的实验流程如下:
![]()
已知:①主要副反应:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。
②有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
溶解性 | 易溶于水 | 难溶于水 | 难溶于水 |
沸点/℃ | 78.5 | 132 | 34.6 |
试回答下列问题:
(1)乙醇与浓硫酸l70℃发生反应的化学方程式:______________________。
(2)乙醇与浓硫酸反应装置中放入几片碎瓷片,目的是_________________________。
(3)反应得到的混合气体中含有SO2、CO2等气体,检验其中的SO2气体可选用的试剂是_______________________________。
(4)吸收步骤中,应适当降低吸收液的温度,其主要目的是______________。
(5)实验制得的1,2-二溴乙烷粗产品中含有少量未反应的Br2和少量副产品乙醚,某同学进一步提纯如下:
序号 | 实验方案 | 实验目的或结论 |
① | 除去粗产品中少量未反应的Br2,实验方法是_________________ | 除去溴杂质 |
② | 除去粗产品中的乙醚的实验方法是将①实验后的有机混合物进行________________________ | 除去乙醚杂质 |
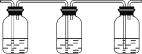
【题目】某研究性学习小组欲开展一次以化学为主题的活动,确定的课题是“研究浓硫酸与木炭粉在加热条件下反应的产物”。根据小组成员的推测,浓硫酸与木炭粉在加热条件下反应的产物可能有CO2、SO2,为了验证推测,小组讨论用以下装置进行实验:
编号 | a | b | c |
装置 |
品红 酸性KMnO4 品红 溶液 溶液 溶液 A B C |
|
|
请回答:
⑴ 实验时可观察装置a中A瓶溶液褪色,C瓶溶液不褪色。则A瓶溶液的作用___,C瓶溶液的作用_____;
⑵ 装置b中所加的液体是________,装置b可验证的产物是________;
⑶ 甲、乙两位同学分别设计了两套不同装置。甲的装置顺序:c→b→a,乙的装置顺序:c→a→b。你认为合理的是(填“甲”或“乙”)__;
⑷写出装置c中发生的化学方程式: __________