题目内容
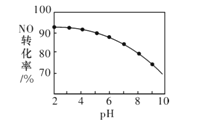
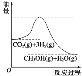
【题目】25℃时,用0.100 mol·L-1的NaOH溶液滴定20.00 mL 0.100 mol·L-1的HNO2溶液,![]() 与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )
与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )

A. 25 ℃时,0.100 mol·L-1的HNO2溶液的pH=2.75
B. B点对应的溶液中,2c(H+)+c(HNO2)=c(NO2-)+2c(OH-)
C. C点对应的溶液的pH=7,加入NaOH溶液的体积为20.00 mL
D. 滴定过程中从A到D点溶液中水的电离程度先增大后减小
【答案】C
【解析】
A.未向HNO2溶液中滴加NaOH溶液时,lg![]() =8.5,则
=8.5,则![]() =108.5,由于c(H+)c(OH-)=10-14,两式联立,可得c(H+)=10-2.75mol/L,所以该溶液的pH=2.75,A正确;
=108.5,由于c(H+)c(OH-)=10-14,两式联立,可得c(H+)=10-2.75mol/L,所以该溶液的pH=2.75,A正确;
B.B点溶液为等浓度的HNO2和NaNO2溶液,溶液中存在电荷守恒:c(H+)+c(Na+)= c(OH-)+c(NO2-),根据物料守恒可得:2c(Na+)= c(NO2-)+c(HNO2),将第一个式子扩大2倍减去第二个式子,整理可得:2c(H+)-c(OH-)=c(Na+)=c(NO2-)-c(HNO2),B正确;
C. C点lg![]() =0,则
=0,则![]() =1,HNO2的电离程度与NaNO2的水解程度相同,则加入NaOH溶液的体积小于20mL,C错误;
=1,HNO2的电离程度与NaNO2的水解程度相同,则加入NaOH溶液的体积小于20mL,C错误;
D.从A到D的过程中,溶液的溶质由酸、酸和盐、盐变为盐和碱,酸或碱抑制水的电离,含有弱离子的盐促进水的电离,故滴定过程中从A到D点,溶液中水的电离程度先增大后减小,D正确;
故合理选项是C。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】某研究性学习小组欲开展一次以化学为主题的活动,确定的课题是“研究浓硫酸与木炭粉在加热条件下反应的产物”。根据小组成员的推测,浓硫酸与木炭粉在加热条件下反应的产物可能有CO2、SO2,为了验证推测,小组讨论用以下装置进行实验:
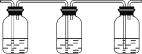
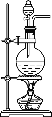
编号 | a | b | c |
装置 |
品红 酸性KMnO4 品红 溶液 溶液 溶液 A B C |
|
|
请回答:
⑴ 实验时可观察装置a中A瓶溶液褪色,C瓶溶液不褪色。则A瓶溶液的作用___,C瓶溶液的作用_____;
⑵ 装置b中所加的液体是________,装置b可验证的产物是________;
⑶ 甲、乙两位同学分别设计了两套不同装置。甲的装置顺序:c→b→a,乙的装置顺序:c→a→b。你认为合理的是(填“甲”或“乙”)__;
⑷写出装置c中发生的化学方程式: __________