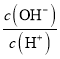��Ŀ����
����Ŀ���״�������Ҫ�Ļ���ԭ�ϣ��ֿ���Ϊȼ�ϣ����úϳ���(��Ҫ�ɷ�ΪCO��CO2��H2)�ڴ��������ºϳɼ״�����������Ҫ��Ӧ���£�
��CO(g)��2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g) ��H2
CH3OH(g)��H2O(g) ��H2
��CO2(g)��H2(g)![]() CO(g)��H2O(g) ��H3
CO(g)��H2O(g) ��H3
��1���ش��������⣺��֪��Ӧ������صĻ�ѧ�������������£�
��ѧ�� | H��H | C��O | C��O | H��O | C��H |
E/(kJ��mol��1) | 436 | 343 | 1 076 | 465 | 413 |
�ɴ˼��㦤H1��______kJ��mol��1����֪��H2����58 kJ��mol��1����H3��_______kJ��mol��1��
(2)��֪�ڳ��³�ѹ�£�
��2CH3OH(l)��3O2(g)===2CO2(g)��4H2O(g) ��H����1 275.6 kJ��mol��1
��H2O(l)===H2O(g) ��H����44.0 kJ��mol��1
д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ_________________��
��3����֪����ʱ���ױȰ����ȶ�����֪��
��P4�����ף�s��+5O2��g��===2P2O5��s����H1
��4P�����ף�s��+5O2��g��===2P2O5��s����H2
�ȽϷ�Ӧ�Ц�H�Ĵ�С����H1_______��H2�����������������=������
��4����֪��ϡ��Һ�У�H+��aq��+OH����aq��===H2O��l����H=��57.3 kJ![]() ����Ũ������ϡ����������Һ��Ӧ����1 molˮ���ų�������_____57.3 kJ�����������������=������
����Ũ������ϡ����������Һ��Ӧ����1 molˮ���ų�������_____57.3 kJ�����������������=������
���𰸡� ��99 ��41 CH3OH(l)��![]() O2(g)===CO2(g)��2H2O ��H����725.8 kJ��mol��1 �� ��
O2(g)===CO2(g)��2H2O ��H����725.8 kJ��mol��1 �� ��
��������(1)��Ӧ��=��Ӧ���ܼ���-�������ܼ��ܣ�����H1=1076kJ��mol-1+2��436kJ��mol-1-(3��413+343+465)kJ��mol-1=-99kJ��mol-1�����ݸ�˹���ɣ���Ӧ��-��Ӧ��=��Ӧ�ۣ�����H3=��H2-��H1=-58kJ��mol-1-(-99kJ��mol-1)=+41kJ��mol-1���ʴ�Ϊ��-99��+41 ��
(2)��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ��H1=-1275.6kJ/mol����H2O(g)=H2O(l) ��H3=-44.0kJ/mol���ɸ�˹���ɢ�+����4���ã�2CH3OH(l)+3O2(g)=2CO2 (g)+4H2O(l) ��H=(-1275.6kJ/mol)+(-44.0kJ/mol)��4=-1451.6kJ/mol�����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽΪCH3OH(l)��![]() O2(g)=CO2(g)��2H2O ����H����725.8 kJ/mol���ʴ�Ϊ��CH3OH(l)��
O2(g)=CO2(g)��2H2O ����H����725.8 kJ/mol���ʴ�Ϊ��CH3OH(l)��![]() O2(g)=CO2(g)��2H2O ����H����725.8kJ/mol��
O2(g)=CO2(g)��2H2O ����H����725.8kJ/mol��
(3)����ʱ���ױȰ����ȶ���˵�����������ߣ���Ӧ�ų��������϶࣬����H��0����ų�������Խ�෴Ӧ��ԽС���ʴ�Ϊ������
(4)Ũ��������ˮ���ȣ��ų�����������57.3kJ���ʴ�Ϊ������

 ͬ����ϰ���ϴ�ѧ������ϵ�д�
ͬ����ϰ���ϴ�ѧ������ϵ�д� ͬ����ϰ����ʦ����ѧ������ϵ�д�
ͬ����ϰ����ʦ����ѧ������ϵ�д� ����ϰ�⽭��ϵ�д�
����ϰ�⽭��ϵ�д�����Ŀ������п����ΪʳƷпǿ������ԭ�ϡ���ҵ�ϳ�����п����������п����п�����Ҫ�ɷ���![]() ������������
������������![]() ��
��![]() ��MgO��CaO�ȣ�������������ͼ���£�
��MgO��CaO�ȣ�������������ͼ���£�

��1������п����ĥ�ɷ۵�Ŀ����_______________��
��2��д��Fe3+ˮ������ӷ���ʽ_________________��
��3�������±����ݣ����ڡ���Һ2����pHʱ�������Ͽ�ѡ�õ��������Ϊ__________��
������ѧʽ |
|
|
|
|
��ʼ������pH |
|
|
|
|
������ȫ��pH |
|
|
|
|
��ʼ�ܽ��pH |
|
|
|
|
Ksp |
|
|
|
|
��4����ҵ�ϴӡ���Һ3����ȡMgO�����У����ʵķ�Ӧ����________ѡ����š�
![]() ����ʯ��
����ʯ�� ![]() ʯ���� c������Һ d��ˮ
ʯ���� c������Һ d��ˮ
��5������Һ4��֮��IJ�������Ϊ________��_______�����ˣ�ϴ�ӣ����
��6������ͼ�����ݣ���п�����![]() ����������������__________�ô���ʽ��ʾ
����������������__________�ô���ʽ��ʾ