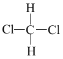
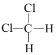
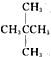题目内容
【题目】溴主要以Br- 形式存在于海水(呈弱碱性)中,利用空气吹出法从海水中提溴,工艺流程示意如下。
![]()
资料:常温下溴呈液态,深红棕色,易挥发。
(1)酸化:将海水酸化的主要目的是避免_______(写离子反应方程式)。
(2)脱氯:除去含溴蒸气中残留的Cl2
①具有脱氯作用的离子是_______。
②溶液失去脱氯作用后,补加FeBr2或加入_______,脱氯作用恢复。
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化为BrO3- 和Br-。再用H2SO4酸化歧化后的溶液得到Br2,其离子反应方程式为_______。
(4)探究(3)中所用H2SO4浓度对Br2生成的影响,实验如下:
序号 | A | B | C |
试剂组成 | 1 mol/L NaBr 20% H2SO4 | 1 mol/L NaBr 98% H2SO4 | 将B中反应后溶液用水稀释 |
实验现象 | 无明显现象 | 溶液呈棕红色,放热 | 溶液颜色变得很浅 |
①B中溶液呈棕红色说明产生了_______。
②分析C中溶液颜色变浅的原因,甲同学认为是发生了化学反应所致;乙同学认为是用水稀释所致。若认为甲同学的分析合理,请用具体的反应说明理由;若认为乙同学的分析合理,进一步设计实验方案说明。理由或方案:_______。
③酸化歧化后的溶液宜选用的酸是______(填“稀硫酸”或“浓硫酸”)。
【答案】Cl2+2OH-=Cl-+ClO-+H2O Fe2+、Br- 铁粉 BrO3- +5Br-+6H+=3Br2+3H2O Br2 理由:SO2+Br2+2H2O=2HBr+H2SO4方案:用CCl4萃取颜色很浅的溶液,观察溶液下层是否呈棕红色 稀硫酸
【解析】
(1)海水中溴元素以Br-存在,从海水中提取溴单质,要用Cl2氧化溴离子得到,但海水呈碱性,若不酸化,就会发生反应:Cl2+2OH-=Cl-+ClO-+H2O,影响溴的提取;
(2) ①将溴蒸气的残留的Cl2脱去,可利用氯气有强的氧化性,要加入能与Cl2反应,但不能与Br2反应的物质,如Fe2+、Br-;
②溶液失去脱氯作用后,补加FeBr2或加入还原铁粉,物质具有还原性,脱氯作用就恢复;
(3)用Na2CO3溶液吸收溴,Br2歧化为BrO3- 和Br-。再用H2SO4酸化,BrO3- 和Br-及H+发生归中反应得到Br2,其离子反应方程式为BrO3- +5Br-+6H+=3Br2+3H2O;
(4)①B中溶液呈棕红色是由于Br2是红棕色物质,产生了Br2;
②若甲同学说法正确,则会发生反应:SO2+Br2+2H2O=2HBr+H2SO4,消耗了溴单质;若乙同学说法正确,则要把颜色很浅的溶液用CCl4萃取,利用CCl4密度比水大,溴单质容易溶于CCl4,观察下层液体颜色否呈棕红色即可;
③歧化后的溶液若用稀硫酸酸化无明显现象,若用浓硫酸酸化,溶液变为红棕色,反应放出热量,会导致溴单质挥发,所以酸化要用稀硫酸。

 名校课堂系列答案
名校课堂系列答案【题目】把浓盐酸分别滴入点滴板上的各种溶液中,现象如下:
实验 | 现象 |
| ①中溶液变蓝 |
②中溶液产生胶状沉淀 | |
③中生成沉淀 | |
④中产生黄绿色气体 |
下列分析不正确的是
A. ①中溶液变蓝,体现了浓盐酸的氧化性
B. ②中产生白色胶状沉淀:2H++SiO32-=H2SiO3
C. ③中产生沉淀的原因可用平衡移动原理解释
D. ④中产生黄绿色气体:ClO-+Cl-+2H+=Cl2↑+H2O
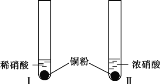
【题目】某学习小组探究稀HNO3、浓HNO3与铜的反应。
装置(尾气处理装置略) | 现象 |
| Ⅰ中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
(1)试管Ⅰ中Cu与稀HNO3反应的化学方程式是________。
(2)Ⅱ中反应的速率比Ⅰ中的快,原因是________。
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;
假设2:溶解了生成的NO2。
探究如下:取Ⅱ中绿色溶液,分为两等份。
①取一份于如图所示装置中,_______(填“操作”和“现象”),证实Ⅱ中溶解了NO2。
②向另一份溶液加入_____(填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1.HNO3浓度越稀,溶液中NO3-的数目越少,被还原时,每个NO3-从还原剂处获得较多电子的机会_____(填“增多”或“减少”),因此被还原为更低价态。
解释2.推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
3NO2+H2O=2HNO3+NO

①B中盛放的试剂是________。
②C中盛放Cu(NO3)2和_________。
③该小组证实推测的合理性所依据的实验现象是________。
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为 ZrSiO4,还含少量FeCO3、Fe2O3、Al2O3、SiO2等杂质)通过如下流程制取。
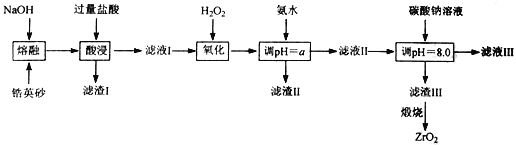
已知:① ZrSiO4能与烧碱反应生成Na2ZrO3和Na2SiO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀pH | 1.9 | 3.3 | 6.2 |
沉淀完全pH | 3.0 | 5.2 | 8.0 |
(1)“熔融”过程中,ZrSiO4发生反应的化学方程式是_________________,滤渣I的化学式为______________________。
(2)“氧化”过程中,发生反应的离子方程式是_________________________________,调“pH=a”时,a的范围是_________________________________。
(3)为得到纯净的ZrO2,滤渣III要用水洗,检验沉淀是否洗涤干净的方法是_____________________。
(4)滤渣Ⅲ的成分是Zr(CO3)2·xZr(OH)4。取干燥后的滤渣Ⅲ 37.0g,煅烧后可得到24.6gZrO2。则x等于______________________;“调pH=8.0”时,所发生反应的离子方程式为_______