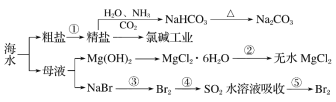
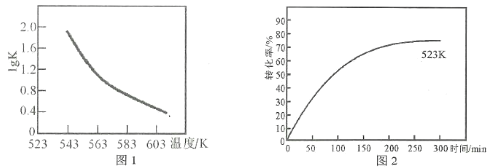
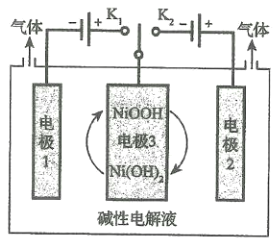
题目内容
【题目】反应A(g)+2B(g)![]() C(g)+D(g) △H=-QkJ·mol-1的能量变化如图所示,有关叙述正确的是( )
C(g)+D(g) △H=-QkJ·mol-1的能量变化如图所示,有关叙述正确的是( )
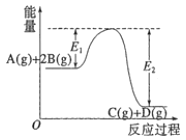
A.Q=E1-E2
B.在反应体系中加入催化剂,反应速率增大,E1减小,E2不变
C.Q>0,升高温度,正反应速率增大,逆反应速率减小
D.若减小体积,平衡会移动,当反应再次达到平衡时,A的平衡浓度增大
【答案】D
【解析】
E1为正反应活化能,E2为逆反应活化能。
A. 焓变△H = E1-E2,Q= E2-E1,故A项错误;
B.催化剂可以同时降低正逆反应活化能,故E1减小,E2减小,故B项错误;
C. Q= E2-E1>0,则△H<0,该反应为放热反应,升高温度,正逆反应速率同时增大,平衡左移,故C项错误;
D.减小体积,各物质的浓度均增大,体系压强增大,平衡右移,当反应再次达到平衡时,根据勒夏特列原理可判断A的平衡浓度增大,故D项正确;
故答案为D。

练习册系列答案
相关题目
【题目】已知X、Y是主族元素,I为电离能,单位是![]() 。请根据下表所列数据判断下列说法,其中错误的是
。请根据下表所列数据判断下列说法,其中错误的是![]()
![]()
元素 |
|
|
|
|
X | 500 | 4600 | 6900 | 9500 |
Y | 580 | 1800 | 2700 | 11600 |
A.元素X常见化合价是![]()
B.元素Y是第ⅢA族元素
C.同周期主族元素中,X的第一电离能最小
D.若元素Y处于第三周期,它可与冷水剧烈反应