题目内容
【题目】苯乙腈主要用于有机合成及生产医药,农药的中间体,对环境有危害。常温常压下,苯乙腈水解一般需加入酸碱催化剂。但研究人员发现,在近临界水(指温度在523~623K之间的压缩液态水)中,不加任何催化剂的情况下,苯乙腈就能发生水解反应生成苯乙酞胺:
C6H5CH2CN(l)+H2O(l) ![]() C6H5CH2CONH2(l) △H
C6H5CH2CONH2(l) △H
(苯乙腈) (苯乙酰胺)
请回答下列问题:
(1)已知近临界水中,水的离子积常数为10-10,则此条件下,pH=7的NaAc溶液中由水电离的c(H+)=________ mol·L-1。该反应不加任何催化剂就能发生的主要原因是____________。
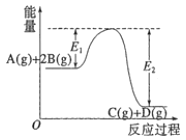
(2)研究反应的平衡常数(记作lgK)与温度(T)的关系,得到如图1所示的关系,判断该反应的△H__________0(填“>”“<”或“=”)。
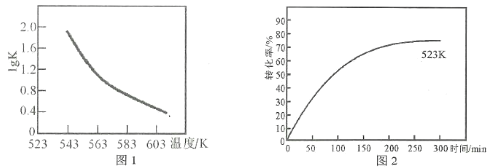
(3)图2表示其他条件不变时,温度和时间对苯乙腈转化率的影响曲线图(不完整)。若图中曲线对应的温度为523K,请你在原图中作出温度为583K的影响曲线。___________。
(4)下列仪器可用于测定苯乙腈相对分子质量的是_________(填编号)。
A.元素分析仪 B.核磁共振仪 C.红外光谱仪 D.质谱仪
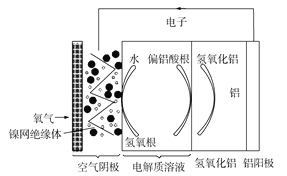
(5)水的用途很广,可利用太阳能光伏电池电解水制高纯氢,工作示意图如图。通过控制开关连接K1或K2,可交替得到H2和O2。
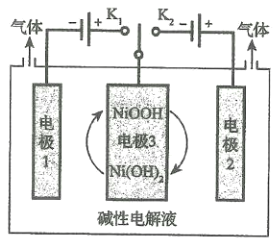
①制H2时,连接______________,可得H2。
②改变开关连接方式,产生O2的电极反应式__________________________。
③选用NiOOH、Ni(OH)2作为电极3材料的优点(请结合电极反应式进行阐述)___________。
【答案】10-3 近临界水中水的电离程度较大,产生的H+、OH-的浓度较大,可起到酸碱催化剂作用 <  D K1 4OH--4e-=2H2O+O2↑或2H2O-4e-=4H++O2↑ 制H2时,电极3:Ni(OH)2+ OH--e-=NiOOH+H2O,消耗电极1产生的OH-,制O2时,电极3:NiOOH+H2O+e-=Ni(OH)2+ OH-,补充电极2消耗的OH-,电极3在上述反应中得以循环使用
D K1 4OH--4e-=2H2O+O2↑或2H2O-4e-=4H++O2↑ 制H2时,电极3:Ni(OH)2+ OH--e-=NiOOH+H2O,消耗电极1产生的OH-,制O2时,电极3:NiOOH+H2O+e-=Ni(OH)2+ OH-,补充电极2消耗的OH-,电极3在上述反应中得以循环使用
【解析】
(1)根据![]() 可知
可知 ,NaAc溶液中由水电离的氢离子浓度和氢氧根浓度是相等的,所以水电离出的c(H+)= 10-3mol/L;近临界水指温度在523~623K之间的压缩液态水,温度较高,升高温度会促进水的电离,电离出的氢离子和氢氧根浓度增大,可做酸碱催化剂,故答案为:10-3;近临界水中水的电离程度较大,产生的H+、OH-的浓度较大,可起到酸碱催化剂作用。
,NaAc溶液中由水电离的氢离子浓度和氢氧根浓度是相等的,所以水电离出的c(H+)= 10-3mol/L;近临界水指温度在523~623K之间的压缩液态水,温度较高,升高温度会促进水的电离,电离出的氢离子和氢氧根浓度增大,可做酸碱催化剂,故答案为:10-3;近临界水中水的电离程度较大,产生的H+、OH-的浓度较大,可起到酸碱催化剂作用。
(2)由图1可知,升高温度lgK减小,即K减小,说明升高温度反应逆向移动,正反应为放热反应,故答案为:<。
(3)正反应为放热反应,升高温度平衡逆向移动,转化率减小,同时反应速率加快,达到平衡所需时间减少,故答案为: 。
。
(4)A.元素分析仪用于测定所含元素;
B.核磁共振仪用于测定分子中氢原子的种类和个数比;
C.红外光谱仪用于测定分子中所含官能团和化学键;
D.质谱仪用于测定相对分子质量;
故答案为:D。
(5)①当需要生产氢气时,氢元素的化合价降低,电解池中与电源负极相连的阴极发生还原反应化合价降低,故答案为:K1;
②当生产氧气时,开关接K2,电极2为阳极产生氧气,故答案为:![]() ;
;
③根据装置图可看出其优点是:制氢气时电极3发生反应:![]() ,消耗电极1产生的OH-;制O2时,电极3发生反应:
,消耗电极1产生的OH-;制O2时,电极3发生反应:![]() ,补充电极2消耗的OH-;电极3在上述反应中得以循环使用。
,补充电极2消耗的OH-;电极3在上述反应中得以循环使用。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】有A、B、C、D、E五种元素,其相关信息如表:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C基态原子的2p轨道中有3个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式_______________。
(2)C元素的第一电离能比氧元素的第一电离能_______________ (填“大”或“小”) 。
(3)CA3分子中C原子的杂化类型是_______________。
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有____(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为____________ (填序号)。
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示,其中D离子的配位数为_______________,若该晶体的密度为a g·cm3,则该晶胞的体积是_____________cm3(写出表达式即可)。