题目内容
【题目】汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统中装置催化转化器,可有效降低NOx和CO的排放。
已知:①2CO(g)+O2(g)![]() 2CO2(g) ΔH=566.0kJ/mol
2CO2(g) ΔH=566.0kJ/mol
②N2(g)+O2(g)![]() 2NO(g) ΔH=+180.5kJ/mol
2NO(g) ΔH=+180.5kJ/mol
③2NO(g)+O2(g)![]() 2NO2(g) ΔH=116.5kJ/mol
2NO2(g) ΔH=116.5kJ/mol
回答下列问题:
(1)CO的燃烧热为___。若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946kJ、498kJ的能量,则1molNO(g)分子中化学键断裂时需吸收的能量为___kJ。
(2)CO将NO2还原为单质的热化学方程式为___。
【答案】283kJ·mol1 631.8 2NO2(g)+4CO(g)![]() N2(g)+4CO2(g) H=-1196kJ·mol1
N2(g)+4CO2(g) H=-1196kJ·mol1
【解析】
(1)CO的燃烧热为1molCO完全燃烧生成1molCO2时释放的能量;已知N2(g)+O2(g)2NO(g)△H=+180.5kJmol-1,正反应为吸热反应,化学键断裂时需吸收的能量-化学键生成时需放出的能量=反应吸收的热量;
(2)根据盖斯定律计算此反应的反应热,写出热化学方程式。
(1)已知2CO(g)+O2(g)2CO2(g)△H=-566.0kJmol-1,可知1molCO完全燃烧生成1molCO2时释放的能量为![]() =283kJ,则CO的燃烧热为283kJ/mol;已知N2(g)+O2(g)2NO(g)△H=+180.5kJmol-1,且1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946kJ、498kJ的能量,设1molNO(g)分子中化学键断裂时需吸收的能量为QkJ,则180kJ=(946kJ+498kJ)-2QkJ,解得:Q=631.8,故答案为:283kJ/mol;631.8;
=283kJ,则CO的燃烧热为283kJ/mol;已知N2(g)+O2(g)2NO(g)△H=+180.5kJmol-1,且1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946kJ、498kJ的能量,设1molNO(g)分子中化学键断裂时需吸收的能量为QkJ,则180kJ=(946kJ+498kJ)-2QkJ,解得:Q=631.8,故答案为:283kJ/mol;631.8;
(2)①2CO(g)+O2(g)2CO2(g) △H=-566.0kJmol-1、②N2(g)+O2(g)2NO(g) △H=+180.5kJmol-1、③2NO(g)+O2(g)2NO2(g) △H=-116.5kJmol-1,根据盖斯定律,将①×2-②-③可得:2NO2(g)+4CO(g)=N2(g)+4CO(g),则△H=(-566.0kJmol-1)×2-(+180.5kJmol-1) - (-116.5kJmol-1)= -1196kJ/mol,则CO将NO2还原的热化学方程式为2NO2(g)+4CO(g)=N2(g)+4CO(g) △H=-1196kJ/mol,故答案为:2NO2(g)+4CO(g)=N2(g)+4CO(g) △H=-1196kJ/mol。

【题目】有A、B、C、D、E五种元素,其相关信息如表:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C基态原子的2p轨道中有3个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式_______________。
(2)C元素的第一电离能比氧元素的第一电离能_______________ (填“大”或“小”) 。
(3)CA3分子中C原子的杂化类型是_______________。
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有____(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为____________ (填序号)。
a.平面正方形 b.正四面体 c.三角锥形 d.V形
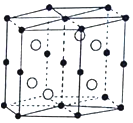
(5)B与D可形成离子化合物,其晶胞结构如图所示,其中D离子的配位数为_______________,若该晶体的密度为a g·cm3,则该晶胞的体积是_____________cm3(写出表达式即可)。