题目内容
7.现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化,均在常温下测定):①向其中一份固体中加入100mL 2.0mol-L-1的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14;
②向另一份固体中加入140mL 4.0mol-L-1的溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=0.
(1)实验①所得溶液中含铝元素的离子在溶液中的物质的量浓度为1mol/L.
(2)元铝热剂混合物中氧化铁粉末的质量为9.6g.
(3)实验②产生气体标准状况下的体积为2.688L.
分析 ①反应后溶液显碱性,说明溶液中元素Al都以AlO2-形式存在,Fe及其氧化物和碱不反应,则溶液里的物质就是NaAlO2、NaOH,其中OH-浓度是1mol/L,则根据钠离子守恒可知,AlO2-的物质的量就是0.1mol;
②反应后pH=0,则反应后氢离子的物质的量是0.14mol,由①可知,在第二个反应中Al3+的物质的量是0.1mol,氯离子的物质的量是0.56mol,所以亚铁离子的物质的量为:(0.56-0.14-0.1×3)mol÷2=0.06mol;
根据反应式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3可知,反应后每一份中单质铁的物质的量是0.06mol,反应后每一份中单质铝的物质的量是:0.1mol-0.06mol=0.04mol,所以Al再和盐酸的反应生成的氢气,据此进行解答.
解答 解:①反应后溶液显碱性,说明溶液中元素Al都以AlO2-形式存在,Fe及其氧化物和碱不反应,则溶液里的物质就是NaAlO2、NaOH,其中OH-浓度是1mol/L,则根据钠离子守恒可知,AlO2-的物质的量就是0.1mol;
②反应后pH=0,则反应后氢离子的物质的量是0.14mol,由①可知,在第二个反应中Al3+的物质的量是0.1mol,氯离子的物质的量是0.56mol,所以亚铁离子的物质的量为:(0.56-0.14-0.1×3)mol÷2=0.06mol;
根据反应式2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3可知,反应后每一份中单质铁的物质的量是0.06mol,反应后每一份中单质铝的物质的量是:0.1mol-0.06mol=0.04mol,所以Al再和盐酸的反应生成的氢气,
(1)反应①中反应后氢氧根离子的物质的量为:1mol/L×0.1L=0.1mol,反应中消耗的氢氧化钠的物质的量为:2mol/L×0.1L-0.1mol=0.1mol,氢氧化钠与铝反应生成偏铝酸钠,则偏铝酸钠的物质的量为0.1mol,偏铝酸根离子浓度为:$\frac{0.1mol}{0.1L}$=1mol/L,
故答案为:1mol/L;
(2)由Fe元素守恒可知,每份铝热剂中n(Fe2O3)=$\frac{1}{2}$n(Fe2+),故整包铝热剂中n(Fe2O3)=0.06mol×$\frac{1}{2}$×2=0.06mol,故整包铝热剂中m(Fe2O3)=0.06mol×160g/mol=9.6g,
故答案为:9.6g;
(3)反应后每一份中单质铁的物质的量是0.06mol,反应后每一份中单质铝的物质的量为:0.1mol-0.06mol=0.04mol,Fe、Al再和盐酸的反应生成的氢气,
2Al~3H2↑,Fe~H2↑,
0.04mol 0.06mol 0.06mol 0.06mol
实验②产生气体的体积为:V=nVm=0.06mol×2×22.4L/mol=2.688L,
故答案为:2.688L.
点评 本题考查混合物计算、铝热反应、金属溶于酸碱的有关计算等,该题难度较大题,既要根据电荷守恒,计算离子的浓度,还要判断铝热反应中反应物的过量问题,对学生的思维能力和审题能力都提出了较高的要求.

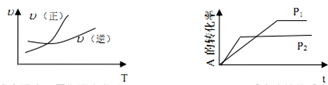
| A. | 升高温度,平衡逆向移动 | B. | m<p,正反应为放热反应 | ||
| C. | m+n<p,正反应为吸热反应 | D. | 减小压强,平衡逆向移动 |
| A. | H2O2的电子式: | B. | CS2的比例模型: | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 苯的分子式: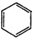 |
| A. | 含有1molFe(OH)3的氢氧化铁胶体中,含有NA个Fe(OH)3胶粒 | |
| B. | 1mol-L-1Na2CO3溶液100mL,含有0.1NA个CO32- | |
| C. | 足量的铁与1molCl2充分反映转移的电子数为3NA | |
| D. | 高温常压下,22.4L的一氯甲烷中含有的分子数小于NA个 |
| A. | ①溶液逐渐变红色的原因是Fe2+被酸性KMnO4溶液氧化 | |
| B. | ②红色逐渐褪去的原因是酸性KMnO4溶液将SCN-氧化 | |
| C. | ②红色逐渐褪去的原因是酸性KMnO4溶液将Cl-氧化 | |
| D. | ③溶液又逐渐变色且为紫色 |
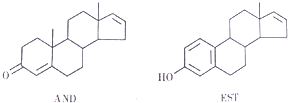
| A. | 这两种分子均能与NaOH溶液反应 | |
| B. | AND和KST分别与足量氢气加成后的两种产物互为同系 | |
| C. | AMD和EST均瓸于芳香族化合物 | |
| D. | EST的M分丼构体中,有的结构中含有葱环(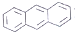 ) ) |
| A. | 溴水 | B. | 碳酸钠溶液 | C. | 紫色石蕊试液 | D. | 金属钠 |
| A. | 将含0.1molFeCl3的溶液滴加到沸水中完全水解可生成0.1NA个Fe(OH)3胶粒 | |
| B. | 常温常压下,0.1molD216O中含中子数、质子数、电子数均为NA | |
| C. | 将0.1molCl2通入1L水中,转移的电子数为0.1NA | |
| D. | 电解饱和食盐水,当阴极产生1.12LH2时,转移的电子数一定为0.1NA |