题目内容
2.向一份FeCl2溶液中滴加少量KSCN(SCN是“类卤离子”,性质与卤素离子相似)溶液,再向此溶液中逐滴滴加酸性KMnO4溶液,产生现象如下:①溶液逐渐变为红色;②红色逐渐褪去;③溶液又逐渐变色.关于上述现象的解释不正确的是( )| A. | ①溶液逐渐变红色的原因是Fe2+被酸性KMnO4溶液氧化 | |
| B. | ②红色逐渐褪去的原因是酸性KMnO4溶液将SCN-氧化 | |
| C. | ②红色逐渐褪去的原因是酸性KMnO4溶液将Cl-氧化 | |
| D. | ③溶液又逐渐变色且为紫色 |
分析 FeCl2和KSCN的混合溶液中,滴加酸性高锰酸钾,FeCl2被氧化为FeCl3,Fe3++3SCN-?Fe(SCN)3,显红色,当高锰酸钾过量时,又把SCN-氧化,溶液褪色,继续滴加KMnO4溶液变紫色,据此分析.
解答 解:A.FeCl2与和KSCN不反应,滴加酸性高锰酸钾,FeCl2被高锰酸钾氧化为FeCl3,Fe3++3SCN-?Fe(SCN)3,溶液显红色,故A正确;
B.当高锰酸钾过量时,已知SCN-是“类卤离子”,性质与卤素离子相似,能被高锰酸钾氧化,所以溶液红色逐渐褪去,故B正确;
C.由B分析可知,红色逐渐褪去的原因是酸性KMnO4溶液将SCN-氧化,故C错误;
D.当SCN-被完全氧化时溶液褪色,继续滴加高锰酸钾,溶液的颜色为高锰酸钾的颜色,即溶液又逐渐变色且为紫色,故D正确.
故选C.
点评 本题考查氧化还原反应,侧重于学生的分析能力和自学能力的考查,注意把握题给信息以及相关物质的性质,难度不大.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 做金属锂与水反应实验时,用镊子取出锂后要用滤纸吸干煤油 | |
| B. | 实验时制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 | |
| C. | 排出碱式滴定管尖嘴端气泡的操作是向上弯曲橡皮管,然后挤压玻璃球 | |
| D. | 实验室配制500mL0.2mol•L-1NaCl溶液,需用托盘天平称量5.85gNaCl固体 |
13.下列有关化学用语表示正确的是( )
| A. | 乙烯的结构简式:C2H4 | |
| B. | 水的电子式: | |
| C. | 氯离子的结构示意图: | |
| D. | 中子数为146,质子数为92的铀(U)原${\;}_{92}^{146}$U |
10.实验室中准备有以下主要仪器及用品,大试管、带导管的单孔塞、药匙、镊子、水槽、集气瓶、玻璃片、酒精灯、铁架台,如果药品选用合理,用以上仪器用品,能完成的实验有( )
| A. | 制取一氧化氮 | B. | 制取乙烯 | C. | 制取乙炔 | D. | 氢气还原氧化铜 |
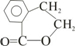
17.松节油结构如图所示,在浓硫酸、加热条件下发生消去反应,最多可以生成几种有机产物( )
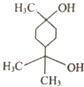

| A. | 4种 | B. | 5种 | C. | 8种 | D. | 9种 |
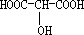 ;
;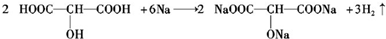 ;
;
 ;
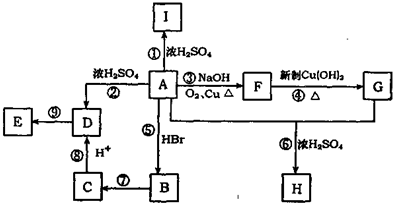
;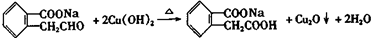 ;写出反应⑦的化学方程式
;写出反应⑦的化学方程式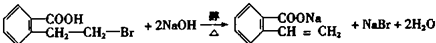 ;
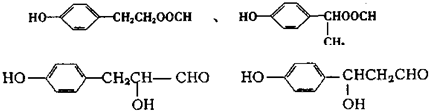
;
 如图为某原电池装置:
如图为某原电池装置: