题目内容
【题目】CH3OCH3(二甲醚)常用作有机合成的原料,也用作溶剂和麻醉剂。CO2与H2合成CH3OCH3涉及的相关热化学方程式如下:
Ⅰ.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
Ⅱ.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
Ⅲ.CO2(g)+H2(g)![]() CO(g)+H2(g) ΔH3
CO(g)+H2(g) ΔH3
Ⅳ.2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH4
CH3OCH3(g)+3H2O(g) ΔH4
回答下列问题:
⑴ΔH4=__kJ·mol-1。
⑵体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应能自发进行。反应Ⅰ、Ⅱ、Ⅲ的自由能变与温度的关系如图a所示,在298~998K下均能自发进行的反应为__(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
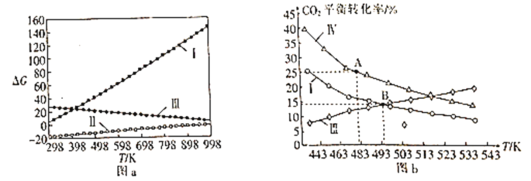
⑶在三个完全相同的恒容密闭容器中,起始时均通入3molH2和1molCO2,分别只发生反应Ⅰ、Ⅲ、Ⅳ时,CO2的平衡转化率与温度的关系如图b所示。
①ΔH3__0(填“>”或“<”)。
②反应Ⅳ,若A点总压强为pMPa,则A点时CO2的分压为p(CO2)__pMPa(精确到0.01)。
③在B点对应温度下, K(Ⅰ)__(填“大于”“小于”或“等于”)K(Ⅲ)。
⑷向一体积为1L的密闭容器中通入H2和CO2,只发生反应Ⅳ。CO2的平衡转化率与压强、温度及氢碳比m[m=![]() ]的关系分别如图c和图d所示。
]的关系分别如图c和图d所示。
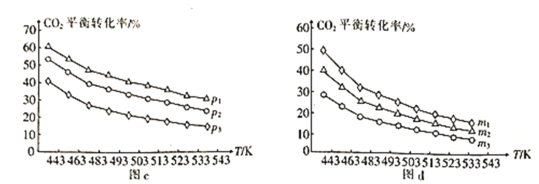
①图c中压强从大到小的顺序为__,图d中氢碳比m从大到小的顺序为__。
②若在1L恒容密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率为50%,则在此温度下该反应的平衡常数K=__(保留整数)。
【答案】-122.54 Ⅱ > 0.21 小于 p1>p2>p3 m1>m2>m3 23
【解析】
⑴第Ⅰ个方程式的2倍加上第Ⅱ个方程式。
⑵根据图中信息得到298~998K下只有Ⅱ的ΔG<0。
⑶①升高温度,CO2的平衡转化率增大,说明平衡正向移动,正向是吸热反应;②三段式式建立关系,根据公式求出压强;③根据平衡常数分析产物与反应物的关系。
⑷①利用转化率分析压强,利用一个量不变,另一个量变化来分析。
②建立三段式建立再求平衡常数。
⑴将第Ⅰ个方程式的2倍加上第Ⅱ个方程式得到ΔH4=-122.54 kJ·mol1;故答案为:-122.54。
⑵体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应能自发进行,在298~998K下只有Ⅱ的ΔG<0,因此均能自发进行的反应为Ⅱ;故答案为:Ⅱ。
⑶①升高温度,CO2的平衡转化率增大,说明平衡正向移动,正向是吸热反应,即ΔH3>0;故答案为:>。
② ,反应Ⅳ,若A点总压强为pMPa,则A点时CO2的分压为
,反应Ⅳ,若A点总压强为pMPa,则A点时CO2的分压为![]() ;故答案为:0.21。
;故答案为:0.21。
③在B点对应温度下,根据Ⅰ.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)和Ⅲ.CO2(g)+H2(g)
CH3OH(g)+H2O(g)和Ⅲ.CO2(g)+H2(g)![]() CO(g)+H2(g)的反应,CO2转化率相等,产物的量相等,但Ⅰ中氢气平衡时量较少,但是大于1的值,由于是浓度三次方,因此平衡常数小,平衡常数K(Ⅰ)小于K(Ⅲ);故答案为:小于。
CO(g)+H2(g)的反应,CO2转化率相等,产物的量相等,但Ⅰ中氢气平衡时量较少,但是大于1的值,由于是浓度三次方,因此平衡常数小,平衡常数K(Ⅰ)小于K(Ⅲ);故答案为:小于。
⑷①该反应是体积减小的反应,图c中定温度,从下到上看,转化率增大,说明平衡正向移动,向体积减小方向移动即加压,压强从大到小的顺序为p1>p2>p3,图d中可以理解为二氧化碳物质的量不变,氢气量不断增加,平衡正向移动,二氧化碳转化率不断增大,因此氢碳比m从大到小的顺序为m1>m2>m3;故答案为:m1>m2>m3。
②若在1L恒容密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率为50%, ,则在此温度下该反应的平衡常数
,则在此温度下该反应的平衡常数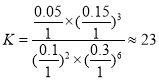 ;故答案为:23。
;故答案为:23。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案