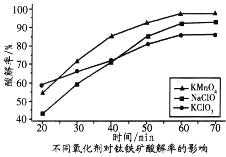
题目内容
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
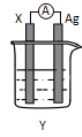
(1)电极X的上发生的电极反应为______反应(氧化或还原);电解质溶液Y是________;
(2)银电极为电池的_____极,发生的电极反应式为_______;
(3)外电路中的电子__________(填“流出”或“流向”)Ag电极。
(4)当有1.6 g铜溶解时,银棒增重______ g。
(5)现有如下两个反应:(A))NaOH+HCl=NaCl+H2O (B)2FeCl3+Fe=3FeCl2
①根据两反应本质,分别判断能否用于设计原电池,如果不能,说明其原因_______________。
②如果可以,写出正极反应式:___________。
【答案】氧化反应AgNO3溶液正Ag++eˉ=Ag流向5.4A不是自发的氧化还原反应Fe3++eˉ=Fe2+
【解析】
(1)根据反应方程式,电极X为Cu,Cu的化合价升高,即电解X为负极,则电极X上发生氧化反应,该反应是Cu和Ag+反应,因此电解质溶液为AgNO3溶液;(2)根据(1)的分析,电极X为负极,则Ag电极为正极,Ag+在正极上得电子,即正极反应式为Ag++e-=Ag;(3)根据原电池的工作原理,电子从负极经外电路流向正极,即从Cu电极经外电路流向Ag电极;(4)负极电极反应式Cu-2e-=Cu2+,根据通过电子相等,建立Cu~2Ag,1.6gCu被消耗,即消耗1.6/64mol=0.025molCu,则生成Ag的质量为2×0.025×108g=5.4g;(5)①A、没有化合价的变化,不属于氧化还原反应,B、存在化合价的变化,属于氧化还原反应,原电池的实质是氧化还原反应,因此A不能设计成原电池;②B能设计成原电池,Fe的化合价升高,即Fe为负极,则正极反应式为Fe3++e-=Fe2+。