题目内容
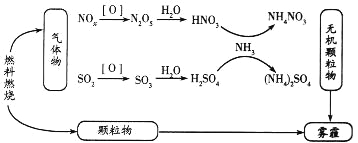
【题目】钛被称为继铁、铝之后的第三金属。工业上常用硫酸酸解钛铁矿(主要成分为FeTiO3,还含有部分Fe2O3)的方法制取金红石(TiO2),再还原TiO2制取金属钛。工业制取TiO2的工艺流程图如下:

回答下列问题:
(1)钛酸亚铁(FeTiO3)中Ti的化合价为________________________。
(2)钛液1中钛以TiO2+的形式存在,则FeTiO3与硫酸反应的离子方程式为________。
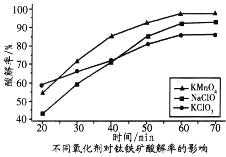
(3)为提高钛铁矿的酸解率,可添加适量氧化剂,依据右图判断,添加的最佳氧化剂为_____________(填化学式)。
(4)钛液1中加入的A物质是____________,流程中的操作a是____________。
(5)制取金红石过程中,需要测定TiO2+的含量。取100mL钛液1,加铝粉,使其发生反应3TiO2++Al+6H+=3Ti3++Al3++3H2O,反应消耗铝1.35g,则钛液1中TiO2+的物质的量浓度为________。
【答案】+4价 FeTiO3+4H+=TiO2++Fe2++2H2O KMnO4 铁粉或铁 洗涤、干燥 1.5mol/L
【解析】
本题主要考查制备实验方案的设计。
钛铁矿和硫酸混合,钛铁矿和硫酸反应的产物之一是TiOSO4,钛铁矿中含有Fe2O3,故反应后的钛液1中含有Fe3+,故需向钛液1中加入铁屑,发生反应2Fe3++Fe=3Fe2+,反应后溶液中溶质为TiOSO4和FeSO4,再将溶液冷却结晶、过滤得到绿矾和钛液2,钛液2中含有TiOSO4,先将钛液2中加入沸水,TiO2+水解生成H2TiO3,然后过滤回收硫酸,同时将固体干燥得到H2TiO3,再经过煅烧得到TiO2,据此分析解答。
(1)钛酸亚铁(FeTiO3)中Fe为+2价,O为-2价,根据化合物中各元素化合价代数和为0可知,Ti为+4价;
(2)由上述分析可知,FeTiO3与硫酸反应的离子方程式为:FeTiO3+4H+=TiO2++Fe2++2H2O;
(3)由图分析可知,最佳氧化剂为KMnO4;
(4)钛液1中含有Fe3+,故需向钛液1中加入铁屑,将Fe3+还原;操作a的目的是得到较纯的H2TiO3固体,故操作a是洗涤、干燥;
(5)由3TiO2++Al+6H+=3Ti3++Al3++3H2O可知,每消耗1molAl的同时,会消耗3molTiO2+,100mL钛液1消耗0.05molAl,即100mL钛液1中含有0.15molTiO2+,故钛液1中TiO2+的物质的量浓度为![]() 。
。

【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
B |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性.Cl2>Br2>I2 |
C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
D | 浓HNO3加热 | 有红棕色气体 | HNO3有强氧化性 |
A. A B. B C. C D. D