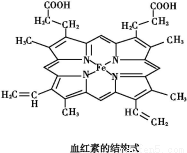
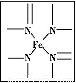
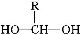
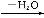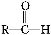题目内容
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA
B.1 mol Na2CO3晶体中含C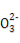 数小于NA
数小于NA
C.惰性电极电解食盐水,若线路中通过NA个电子,则阳极产生气体11.2 L
D.0.1 mol的CaO2中含阴离子数是0.2NA
A
【解析】由O2过量,故0.1 mol Na与之反应无论生成Na2O还是Na2O2,Na失去的电子数为0.1NA,A项正确;1 mol Na2CO3晶体中含C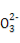 1 mol,故该晶体中含C
1 mol,故该晶体中含C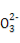 的数目为NA,B项错误;电解食盐水时阳极反应式为2Cl--2e-
的数目为NA,B项错误;电解食盐水时阳极反应式为2Cl--2e-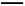 Cl2↑,据此可求得电路中通过NA个电子时,产生Cl2的物质的量为0.5 mol,但不知是否为标准状况下,故无法确定产生气体的体积,C项错误;CaO2中的阴离子为
Cl2↑,据此可求得电路中通过NA个电子时,产生Cl2的物质的量为0.5 mol,但不知是否为标准状况下,故无法确定产生气体的体积,C项错误;CaO2中的阴离子为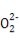 ,故0.1 mol的CaO2中含
,故0.1 mol的CaO2中含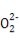 数为0.1NA,D项错误。
数为0.1NA,D项错误。

已知25 ℃时有关弱酸的电离平衡常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离平衡常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
则下列有关说法正确的是( )
A.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于b
B.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
C.各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa)
D.在0.1 mol/L CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
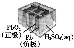
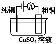
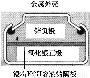
有关下列四个常用电化学装置的叙述中,正确的是( )
|
|
|
|
图Ⅰ 碱性 锌锰电池 | 图Ⅱ 铅 酸蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌 纽扣电池 |
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C.图Ⅲ所示装置工作过程中,电解质溶液中浓度始终不变
D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag