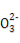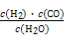题目内容
电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100 mol·L-1 NH3·H2O溶液滴定10.00 mL浓度均为0.100 mol·L-1盐酸和CH3COOH溶液的混合溶液,所得曲线如图所示。下列说法正确的是( )
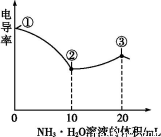
A.①点溶液中c(H+)为0.200 mol·L-1
B.溶液温度高低为①>③>②
C.③点溶液中有c(Cl-)>c(CH3COO-)
D.③点后因离子数目减少使溶液电导率略降低
C
【解析】①点尚未开始滴定,由于CH3COOH是弱酸,存在电离平衡,此时c(H+)<0.200 mol·L-1,A选项错;由于中和反应为放热反应,随着反应进行溶液温度升高,B选项错;③点时加入20 mL NH3·H2O 溶液恰好把HCl、CH3COOH完全中和,生成等物质的量的NH4Cl与CH3COONH4,由于CH3COO-发生水解,导致其浓度降低,c(Cl-)>c(CH3COO-),C选项正确;③点后,继续滴加氨水,中和反应已进行完全,溶液体积增大造成离子浓度降低,电导率下降,D选项错。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案在一定条件下,将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中发生下述反应:PCl3(g)+Cl2(g) PCl5(g),5 min末达到平衡,有关数据如表。
PCl5(g),5 min末达到平衡,有关数据如表。
| PCl3(g) | Cl2(g) | PCl5(g) |
初始浓度(mol·L-1) | 2.0 | 1.0 | 0 |
平衡浓度(mol·L-1) | c1 | c2 | 0.4 |
下列判断不正确的是( )
A.若升高温度,反应的平衡常数减小,则正反应为吸热
B.反应5 min内,v(PCl3)=0.08 mol·L-1·min-1
C.当容器中Cl2为1.2 mol时,可逆反应达到平衡状态
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol·L-1
某混合溶液中可能含有的离子如下表所示:
可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
可能大量含有的阴离子 | Cl-、Br-、I-、CO32—、AlO2— |
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示。
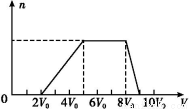
①该溶液中一定不存在的阳离子是 ,
一定不存在的阴离子是 ;含有的阳离子其对应物质的量浓度之比为 ;
②请写出沉淀减少过程中发生反应的离子方程式 。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 11.2 L | 22.4 L | 28.0 L |
n(Cl-) | 2.5 mol | 3.5 mol | 4.0 mol |
n(Br-) | 3.0 mol | 2.5 mol | 2.0 mol |
n(I-) | x mol | 0 | 0 |
①当起始至通入Cl2的体积为22.4 L时,溶液中发生反应总的离子方程式为 ;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为 。