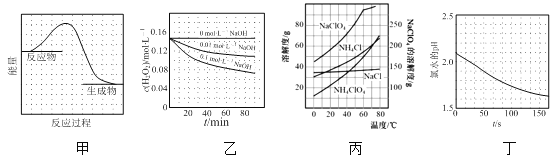
题目内容
【题目】透明聚酯玻璃钢可用于制造导弹的雷达罩和宇航员使用的氧气瓶。制备它的一种配方中含有下列四种物质:
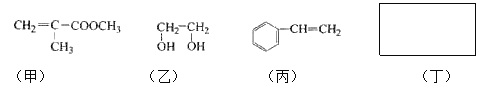
填写下列空白:
(1)甲中不含氧原子的官能团是____________;下列试剂能与甲反应而褪色的是___________(填标号)
a. Br2/CCl4溶液 b.石蕊溶液 c.酸性KMnO4溶液
(2)甲的同分异构体有多种,写出其中一种不含甲基的羧酸的结构简式:_______
(3)淀粉通过下列转化可以得到乙(其中A—D均为有机物):

A的分子式是___________,试剂X可以是___________。
(4)已知: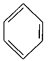 +RCl
+RCl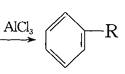 +HCl(-R为烃基)
+HCl(-R为烃基)
 +H2
+H2
利用上述信息,以苯、乙烯、氯化氢为原料经三步反应合成丙,其中属于取代反应的化学方程式是 ______________ 。
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110。丁与FeCl3溶液作用现特征颜色,且丁分子中烃基上的一氯取代物只有一种。则丁的结构简式为 ___________。
【答案】碳碳双键(或![]() ) ac CH2=CH-CH2-CH2-COOH C6H12O6 Br2/CCl4
) ac CH2=CH-CH2-CH2-COOH C6H12O6 Br2/CCl4 ![]() +CH3CH2Cl
+CH3CH2Cl![]() +HCl
+HCl ![]()
【解析】
(1)根据有机物甲的结构简式确定不含氧原子的官能团,有机物甲含有碳碳双键,可以与溴发生加成反应,可以被酸性高锰酸钾氧化;
(2)甲的同分异构体中不含甲基的羧酸,没有支链、碳碳双键处于碳链的一端,据此书写;
(3)淀粉水解生成葡萄糖,葡萄糖转化生成乙醇,乙醇发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷水解生成乙二醇;
(4)乙烯与HCl发生加成反应生成CH3CH2Cl,由信息可知,苯与CH3CH2Cl发生取代反应生成乙苯,乙苯在催化剂的作用下生成苯乙烯;
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110,丁与FeCl3溶液作用显现特征颜色,分子中含有酚羟基-OH,结合相对分子质量,可知丁含有1个苯环,假设为二元取代,则剩余的式量为110-Mr(OH)-Mr(C6H4)=17,故剩余基团为-OH,烃基上的一氯取代物只有一种,说明苯环中只有1种H原子,2个-OH处于对位,据此生成丁的结构简式。
(1)根据有机物甲的结构简式可知不含氧原子的官能团为碳碳双键,有机物甲含有C=C双键,可以与溴发生加成反应,Br2的CCl4溶液褪色,可以被酸性高锰酸钾氧化,使酸性高锰酸钾褪色,不能使石蕊溶液褪色,故答案为ac;
(2)甲的同分异构体中不含甲基的羧酸,没有支链、碳碳双键处于碳链的一端,故符合条件的甲的同分异构体为CH2=CH-CH2-CH2-COOH;
(3)淀粉水解生成葡萄糖,葡萄糖转化生成乙醇,乙醇发生消去反应生成乙烯,乙烯与溴的四氯化碳溶液发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷水解生成乙二醇;
(4)乙烯与HCl发生加成反应生成CH3CH2Cl,由信息可知,苯与CH3CH2Cl发生取代反应生成乙苯,乙苯在催化剂的作用下发生消去反应生成苯乙烯,属于取代反应的化学方程式为:![]() +CH3CH2Cl
+CH3CH2Cl![]() +HCl;
+HCl;
(5)化合物丁仅含碳、氢、氧三种元素,相对分子质量为110,丁与FeCl3溶液作用显现特征颜色,分子中含有酚羟基-OH,结合相对分子质量,可知丁含有1个苯环,假设为二元取代,则剩余的式量为110-Mr(OH)-Mr(C6H4)=110-17-76=17,故剩余基团为-OH,烃基上的一氯取代物只有一种,说明苯环中只有1种H原子,2个-OH处于对位,故丁的结构简式为![]() 。
。

【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)①铜或铜盐的焰色反应为绿色,下列有关原理分析的叙述正确的是___ (填字母)。
A. 电子从基态跃迁到较高的激发态 B. 电子从较高的激发态跃迁到基态
C. 焰色反应的光谱属于吸收光谱 D. 焰色反应的光谱属于发射光谱
②碘、铜两种元素的电负性如表:
元素 | I | Cu |
电负性 | 2.5 | 1.9 |
CuI属于_______(填“共价”或“离子”)化合物。
(2)氯化铁溶液用于检验食用香精乙酰乙酯时,会生成紫色配合物,其配离子结构如图所示。
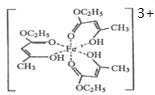
①此配合物中,基态铁离子的价电子排布图为________________。
②此配合物中碳原子的杂化轨道类型有________________。
③此配离子中含有的化学键有____________(填字母)。
A.σ键 B.π键 C.极性键 D.非极性键 E. 配位键 F. 氢键 G.离子键
(3)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是_____________。
(4)治疗铅中毒可滴注依地酸(别名EDTA,结构如下面左图)钠钙,使Pb2+转化为依地酸铅盐。下列说法正确的是_________(填标号)
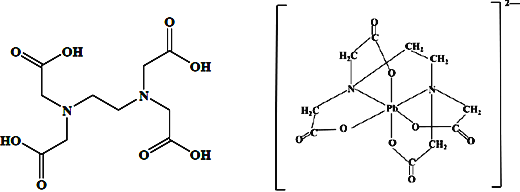
A.形成依地酸铅离子所需n(Pb2+):n(EDTA)=1:4
B.依地酸中各元素的电负性从大到小的顺序为O>N>C>H
C.依地酸铅盐中含有离子键和配位键
(5)AlCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态还是气态,一个分子中的氯原子与另外一个铝原子形成配位键,因此以二聚体Al2Cl6的形式存在,写出Al2Cl6的结构式_______(用→标出配位键)。