题目内容
13.已知室温下BaSO4在纯水中的溶解度为1.07×10-5mol•L-1,BaSO4在0.010mol•L-1Na2SO4溶液中的溶解度是在纯水中溶解度的多少倍?已知KSP(BaSO4)=1.07×10-10.分析 0.010mol•L-1Na2SO4溶液中硫酸根的浓度为0.01omol/L,然后依据KSP(BaSO4)=1.07×10-10,计算钡离子浓度,钡离子来源于硫酸钡的溶解,据此计算溶解度即可.
解答 解:Ksp (BaSO4)=1.07×10-10,那么 在0.010mol•L-1Na2SO4溶液中,c(Ba2+)=$\frac{1.07×1{0}^{-10}}{0.010}$=1.07×10-8,这个也就是BaSO4在Na2SO4中的溶解度,是BaSO4在纯水中溶解度的$\frac{1.07×1{0}^{-8}}{1.07×1{0}^{-5}}$=1×10-3倍,
答:BaSO4在0.010mol•L-1Na2SO4溶液中的溶解度是在纯水中溶解度的1×10-3倍.
点评 本题主要考查的是溶度积常数的意义以及其应用,抓住溶液中离子的来源解题是关键,难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
3.如图表示从固体混合物中分离X的两种方案,请根据方案1和方案2指出下列说法合理的是( )
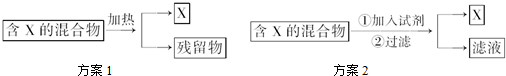

| A. | 可以选用方案1分离碳酸氢钠中含有的氯化铵 | |
| B. | 方案1中残留物可以受热不易挥发 | |
| C. | 方案2中加入的试剂一定能够与除X外的物质发生化学反应 | |
| D. | 方案2中加入NaOH溶液可以分离出SiO2和Fe2O3混合物中的Fe2O3. |
4.下列有关氨及氨水的说法中,正确的是( )
| A. | NH3是10电子分子,具有还原性 | B. | 液氨、氨气、氨水是同一种物质 | ||
| C. | 氨气是非电解质,氨水是电解质 | D. | NH3•H2O是混合物 |
1.下列离子方程式书写不正确的是( )
| A. | 常温下氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | 铜与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
8.对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题.(用元素符号或化学式回答)
(1)能形成共价键的元素有H、C、N、O、F、S、Cl元素.
(2)只需形成一个共价单键就能达到稳定结构的元素有H、F、Cl.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | ② | ||||||
| 2 | ③ | ④ | ⑤ | ⑥ | ||||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ |
(2)只需形成一个共价单键就能达到稳定结构的元素有H、F、Cl.
18.下列做法或实验操作正确的是( )
| A. | 振荡分液漏斗时应关闭其玻璃塞和活塞 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 在50mL量筒中配制0.1000mol•L-1碳酸钠溶液 | |
| D. | 检验NH4+时,向试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 |
5.在容积一定的密闭容器中,反应2A?B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是( )
| A. | 正反应是吸热反应,且A不是气态 | B. | 正反应是放热反应,且A不是气态 | ||
| C. | 正反应是吸热反应,且A是气态 | D. | 正反应是放反应,且A是气态 |
13.下列选项中最后的物质是要制取的物质,其中不能通过所列变化得到的是( )
| A. | Cu$→_{v}^{O_{2}}$CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4溶液$\stackrel{结晶}{→}$CuSO4•5H2O | |
| B. | Al$→_{v}^{O_{2}}$Al2O3$\stackrel{{H}_{2}S{O}_{4}}{→}$Al2(SO4)3溶液$\stackrel{加热蒸干}{→}$Al2(SO4)3 | |
| C. | FeSO4溶液$\stackrel{{H}_{2}S}{→}$FeS$→_{干燥}^{过滤}$FeS晶体 | |
| D. | MgCl2溶液$→_{过滤}^{NH_{3}}$Mg(OH)2$\stackrel{适量HN{O}_{3}}{→}$Mg(NO3)2溶液$\stackrel{结晶}{→}$Mg(NO3)•6H2O |

