题目内容
【题目】25℃时,CH3COOH的电离常数Ka=1.8×10-5。常温下,往25ml氢氧化钠标准溶液中逐滴加入0.2 mol·L-1的CH3COOH溶液,pH变化曲线如下图所示:
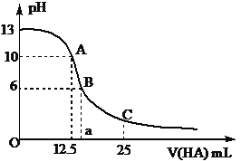
(1)该氢氧化钠溶液的物质的量浓度为________mol·L-1。
(2)A点对应酸的体积为12.5ml,则所得混合溶液中由水电离出的c(OH-)=____ mol·L-1。
(3)B点所示溶液中,c(CH3COO-)-c(Na+)=_______________ mol·L-1(填精确值),c(CH3COO-)/c(CH3COOH)=_______。
(4)C点所示溶液中,c(CH3COOH)_______c(CH3COO-)。(填“>”、“<”或“=”)
(5)向300 mL上述NaOH溶液中通入448 mL CO2(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是________.
A.c(Na+)+ c(H+)= c(OH-)+ c(HCO3-)+ c(CO32-)
B.2/3c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+)
D.c(Na+)> c(HCO3-)> c(CO32-)> c(OH-)> c(H+)
【答案】0.1 1×10-4 9.9×10-7 18 < BD
【解析】
(1)由图可以看出当未滴加醋酸时pH,可求c(NaOH);
(2)A点时醋酸和氢氧化钠,恰好完全反应,生成CH3COONa,溶液的pH=10,此时是CH3COONa水解是溶液显碱性,由此分析得出由水电离出的c(OH-);
(3)B点所示溶液pH=6,可以看成是,CH3COONa和CH3COOH的混合溶液,依据溶液中的守恒关系和醋酸的电离平衡常数可得到答案;
(4)C点所示溶液是CH3COONa和CH3COOH的混合溶液,溶液显酸性,CH3COONa的水解程度小于CH3COOH的电离程度;
(5)依据题给数据计算,溶液的成分,然后依据溶液中的守恒关系可得结论;
(1)因为开始时pH=13,所以c(OH-)=0.1mol/L,故c(NaOH)=0.1mol/L;
本题答案为:0.1mol/L。
(2)由题中数据可知,A点时醋酸和氢氧化钠,恰好完全反应,生成CH3COONa,因CH3COONa水解是溶液显碱性,所以溶液中OH-都是水电离得到的,此时pH=10,溶液中的c(OH-)=1![]() 10-4mol/L,则混合溶液中由水电离出的c(OH-)= 1
10-4mol/L,则混合溶液中由水电离出的c(OH-)= 1![]() 10-4mol/L;
10-4mol/L;
本题答案为:1×10-4。
(3)由图可看出,B点所示溶液pH=6,是CH3COONa和CH3COOH的混合溶液,溶液中的电荷守恒为:c(CH3COO-)![]() c(OH-)=c(Na+)
c(OH-)=c(Na+)![]() c(H+),所以c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=1
c(H+),所以c(CH3COO-)-c(Na+)=c(H+)-c(OH-)=1![]() 10-6-1
10-6-1![]() 10-8=9.9
10-8=9.9![]() 10-7mol/L;因为醋酸的电离平衡常数为:Ka=1.8×10-5,所以c(CH3COO-)/c(CH3COOH)= Ka/c(H+)=
10-7mol/L;因为醋酸的电离平衡常数为:Ka=1.8×10-5,所以c(CH3COO-)/c(CH3COOH)= Ka/c(H+)=![]() =18;
=18;
本题答案为:9.9×10-7,18。
(4)由于c(NaOH)=0.1mol/L,可知C点所示溶液是CH3COONa和CH3COOH等物质的量的混合溶液,溶液显酸性,CH3COONa的水解程度小于CH3COOH的电离程度,所以c(CH3COOH)![]() c(CH3COO-);
c(CH3COO-);
本题答案为:<。
(5)300 mL 0.1mol/L的NaOH溶液中,n(NaOH)=0.03mol, 448 mL CO2的物质的量为n(CO2)=0.02mol,充分反应后,可知n((Na2CO3)=n(NaHCO3)=0.01mol,依据溶液中的物料守恒关系可得:2/3c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3),又混合溶液显碱性,是碳酸钠和碳酸氢钠水解的结果,且等物质的量的碳酸钠比碳酸氢钠水解程度更大,所以有c(Na+)> c(HCO3-)> c(CO32-)> c(OH-)> c(H+);
本题答案为:BD。

【题目】三氯化铁在印刷、医药、颜料、污水处理以及有机合成催化剂方面有重要的应用。工业上常以废铁屑(含有SiO2、Al2O3、MgO、Fe2O3等杂质)为原料制备氯化铁。其生产流程如图:

已知:氢氧化物的Ksp下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
Ksp | 1.0×10-36 | 1.6×10-14 | 2.0×10-33 | 1.2×10-11 |
请回答下列问题:
(1)物质X最好选用下列物质中的____(选填序号),加入X的目的是_________。
A.KMnO4 B.FeCl3 C.H2O2 D.HNO3
(2)滤液Ⅰ加入NaOH溶液的目的是调节溶液的pH。已知滤液Ⅰ中c(Fe3+)为1.0mol·L-1,c(Al3+)为0.03mol·L-1,当Fe3+沉淀完全时(c(Fe3+)为1×10-5mol·L-1),Al3+是否已经开始沉淀,请通过计算说明______________。
(3)写出滤渣1加NaOH溶液发应的离子方程式_____________________。
(4)滤渣2中加过量盐酸的目的是_____________________________。
(5)FeCl3具有净水作用,但易腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。
①FeCl3净水的原理是________。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)_________。
②FeCl3在溶液中分三步水解:Fe3++H2O![]() Fe(OH)2++H+ K1,Fe(OH)2++H2O
Fe(OH)2++H+ K1,Fe(OH)2++H2O![]() Fe(OH)2++H+ K2,Fe(OH)2++H2O
Fe(OH)2++H+ K2,Fe(OH)2++H2O![]() Fe(OH)3+H+ K3,以上水解反应的平衡常数K1、K2、K3由大到小的顺序是_______。
Fe(OH)3+H+ K3,以上水解反应的平衡常数K1、K2、K3由大到小的顺序是_______。
③通过控制条件,以上水解产物聚合,生成聚合氯化铁,离子方程式为xFe3++yH2O![]() Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)_____。
Fex(OH)y(3x-y)++yH+,欲使平衡正向移动可采用的方法是(填序号)_____。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是___________。
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。

请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
(1)操作I加入X的目的是___________________________ 。
(2)下列物质都可以作为X,适合本实验的X物质可以是_________(填字母)。
A.KMnO4 B.NaClO C.H2O2 D.K2Cr2O7
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)__________________________________________。
(5)若要得无水CuCl2,请简述操作方法__________________________。





