题目内容
【题目】甲醇是最基本的有机化工原料之一。工业上可用二氧化碳和氢气反应来生产甲醇。
(1)已知气态甲醇的燃烧热为a kJ/mol,2H2(g)+O2(g) = 2H2O(g) ΔH= -bkJ/mol;H2O(g)=H2O(l) ΔH= -ckJ/mol。 则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH=_________。
CH3OH(g)+H2O(g)的ΔH=_________。
(2)某温度下,在2 L密闭容器中,充入2.4 mol CO2和4.4 mol H2,发生合成甲醇的反应,测得甲醇的物质的量随时间的变化图像如图中的曲线I,则前4分钟ν(CO2)=__________;若在1 min时,改变某一反应条件,曲线I变为曲线II,则改变的条件为___________;该温度下反应的化学平衡常数为___________。

(3)在另一温度下发生合成甲醇的反应,如图关闭K,向A容器中充入1 mol CO2和4 mol H2,向B容器中充入1.2 mol CO2和4.8 mol H2,两容器分别发生上述反应。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为0.9a L,维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为______L(不考虑温度的变化,P为可自由滑动活塞,不考虑活塞的摩擦力)。

(4)一定条件下甲醇可进一步氧化转化为甲酸。室温下,将amol/L的甲酸与bmol/L的NaOH溶液等体积混合,体系中存在c(Na+)=c(HCOO-),试用含a和b的代数式表示甲酸的电离常数为_____________________。
【答案】a-3/2b-2c kJ/mol 0.1 mol·L-1·min-1 加入催化剂 0.2 0.65a b·10-7/(a-b)
【解析】
(1)根据题意,利用盖斯定律,求算CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH;
CH3OH(g)+H2O(g)的ΔH;
(2)根据图像,分析得出4分钟内,甲醇的浓度变化,进而求出二氧化碳的浓度变化,再求ν(CO2);1min改变条件的结果是,速率加快,平衡时间缩短,平衡时c(CH3OH)没有改变,以此判断改变的条件,并计算平衡常数;
(3)打开K时AB组成的是等温等压容器,相应的起始投入总物质的量,与平衡总体积成正比;
(4)根据溶液中的电荷守恒,和c(Na+)=c(HCOO-)的关系,结合甲酸的电离方程式,求算甲酸的电力平衡常数。
(1)依据题给信息,①CH3OH(g)![]() 3/2O2(g)=CO2(g)
3/2O2(g)=CO2(g) ![]() 2H2O(l) ΔH=-akJ/mol, ②2H2(g)+O2(g) = 2H2O(g) ΔH= -b kJ/mol;③H2O(g)=H2O(l) ΔH= -c kJ/mol,根据盖斯定律,3/2
2H2O(l) ΔH=-akJ/mol, ②2H2(g)+O2(g) = 2H2O(g) ΔH= -b kJ/mol;③H2O(g)=H2O(l) ΔH= -c kJ/mol,根据盖斯定律,3/2![]() ②
②![]() 3
3![]() ③-①可得:CO2(g)+3H2(g)
③-①可得:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH= a-3/2b-2c kJ/mol;
CH3OH(g)+H2O(g) ΔH= a-3/2b-2c kJ/mol;
本题答案为:a-3/2b-2c kJ/mol。
(2)根据图像,分析得出4分钟内,甲醇的浓度变化,![]() c(CH3OH)=0.4mol/L,依据则v(CH3OH)=0.4mol/L/4min=0.1mol/(L·min) ,由于速率之比等于计量数之比,所以ν(CO2)= v(CH3OH)= 0.1mol/(L·min);1min时改变条件的结果是曲线I变为曲线II,速率加快,平衡时间缩短,平衡时c(CH3OH)没有改变,根据反应CO2(g)+3H2(g)
c(CH3OH)=0.4mol/L,依据则v(CH3OH)=0.4mol/L/4min=0.1mol/(L·min) ,由于速率之比等于计量数之比,所以ν(CO2)= v(CH3OH)= 0.1mol/(L·min);1min时改变条件的结果是曲线I变为曲线II,速率加快,平衡时间缩短,平衡时c(CH3OH)没有改变,根据反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH= a-3/2b-2c kJ/mol,可知改变的条件是:加入催化剂;由图像可知,平衡时c(CH3OH)=0.4mol/L,,
CH3OH(g)+H2O(g) ΔH= a-3/2b-2c kJ/mol,可知改变的条件是:加入催化剂;由图像可知,平衡时c(CH3OH)=0.4mol/L,,![]() n(CH3OH)=0.4mol/L
n(CH3OH)=0.4mol/L![]() 2L=0.8mol,c(H2O)=0.4mol/L,故由方程式可知:
2L=0.8mol,c(H2O)=0.4mol/L,故由方程式可知:![]() n(CO2)=0.8mol,平衡时c(CO2)=(2.4-0.8)/2=0.8mol/L,
n(CO2)=0.8mol,平衡时c(CO2)=(2.4-0.8)/2=0.8mol/L,![]() n(H2)=3
n(H2)=3![]() 0.8mol=2.4mol,平衡时c(H2)=(4.4-2.4)/2=1mol/L,该温度下平衡常数K= c(CH3OH)·c(H2O)/ c(CO2)·c3(H2)=0.2
0.8mol=2.4mol,平衡时c(H2)=(4.4-2.4)/2=1mol/L,该温度下平衡常数K= c(CH3OH)·c(H2O)/ c(CO2)·c3(H2)=0.2
本题答案为:0.1 mol·L-1·min-1 ; 加入催化剂 ;0.2 。
(3)打开K时AB组成的是等温等压容器,相应的起始投入总物质的量,与平衡总体积成正比,设打开K重新达到平衡,总体积为x,则有:x:(5![]() 6)=0.9a:6,解得x=1.65a,因为起始时A的体积为aL,所以重新平衡时B的体积为:1.65a-a=0.65aL;
6)=0.9a:6,解得x=1.65a,因为起始时A的体积为aL,所以重新平衡时B的体积为:1.65a-a=0.65aL;
本题答案为:0.65a。
(4)根据溶液中的电荷守恒:c(Na+)![]() c(H+)=c(HCOO-)
c(H+)=c(HCOO-)![]() c(OH-),而体系中c(Na+)=c(HCOO-),故c(H+)= c(OH-)=1
c(OH-),而体系中c(Na+)=c(HCOO-),故c(H+)= c(OH-)=1![]() 10-7mol/L,c(Na+)=c(HCOO-)=b/2mol/L,反应后溶液中剩余c(HCOOH)=(a/2-b/2)mol/L,依据HCOOH
10-7mol/L,c(Na+)=c(HCOO-)=b/2mol/L,反应后溶液中剩余c(HCOOH)=(a/2-b/2)mol/L,依据HCOOH![]() HCOO-
HCOO-![]() H+,所以甲酸的电离平衡常数为Ka=c(HCOO-)c(H+)/c(HCOOH)=
H+,所以甲酸的电离平衡常数为Ka=c(HCOO-)c(H+)/c(HCOOH)=![]() = b·10-7/(a-b);
= b·10-7/(a-b);
本题答案为:b·10-7/(a-b)。

【题目】金属钒熔点高、硬度大,具有良好的可塑性和低温抗腐蚀性.工业常用钒炉渣(主要含FeO·V2O3,还有少量Al2O3、CuO等杂质)提取金属钒,流程如图:

已知:
I.钒有多种价态,其中+5价最稳定.钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡:VO2++H2OVO3+2H+.
Ⅱ.部分离子的沉淀pH:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀PH | 5.2 | 7.6 | 2.7 |
完全沉淀PH | 6.4 | 9.6 | 3.7 |
回答下列问题
(1)碱浸步骤中最好选用______________(填字母)
a. NaOH溶液 b.氨水c.纯碱溶液
(2)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,其中铁元素全部转化为+3价的氧化物,写出该反应的化学方程式___________________________________
(3)溶液1到溶液2的过程中,调节pH至8有两个目的,一是除去________离子,二是促使_________.
(4)沉钒过程中得到NH4VO3沉淀需要洗涤,写出实验室洗涤的操作方法____________________.
(5)常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式____________________________.
(6)钒的化合物也有广泛的用途,如一种新型铝离子可充电电池的结构如图所示.
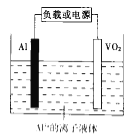
已知放电时电池反应为xAl+VO2=AlxVO2↓,则放电时正极的电极反应式为_____________________.