题目内容
4.短周期原子序数依次递增的A、B、C、D、E、F六种元素,已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍;C原子内层电子总数是最外层电子数10倍;A、B、D三种元素的原子最外层电子数之和为13;A和B原子最外层电子数与D和F原子最外层电子数之和相等;D和E是相邻两种元素.(1)E元素基态原子的核外电子占用了8个原子轨道;F元素的名称:氯.
(2)A和E元素的最高价含氧酸的酸性较强的是H2CO3;(填化学式)
(3)A、B、C三种元素组成原子个数比n(A):n(B):n(C)=1:3:2的化合物,用离子方程式表示该化合物的水溶液显碱性的原因CO32-+H2O?HCO3-+OH-.
(4)B、C、D三种元素原子半径最大的是Na(填元素符号),离子半径最小的是Al3+(填离子符号).M元素与D元素位于不同主族,但由于二者的电负性相近,导致某些性质相似.将M的最高价氧化物溶于C的氢氧化物的水溶液中,发生反应的离子方程式为BeO+2OH-=BeO22-+H2O.
(5)E和F形成的化合物X在高温条件下可以被氢气还原,工业上常用此反应制取高纯度的单质E,写出该化学反应的方程式SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl.
分析 短周期原子序数依次递增的A、B、C、D、E、F六种元素,B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍,则A原子只能有2个电子层,故B元素最外层电子数为6,D原子最外层电子数为3,A的次外层电子数为2;C原子内层电子总数是最外层电子数10倍,则C为Na,B的原子序数小于钠,则B为O元素;A、B、D三种元素的原子最外层电子数之和为13,则A的最外层为13-6-3=4,所以A的核外电子数为2+4=6,故A为C元素;A和B原子最外层电子数与D和F原子最外层电子数之和相等,则F的最外层为7,F的原子序数最大,故F为Cl元素;D和E是相邻两种元素,D原子最外层电子数为3,所以D为Al元素,E为Si元素,据此解答.
解答 解:短周期原子序数依次递增的A、B、C、D、E、F六种元素,B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍,则A原子只能有2个电子层,故B元素最外层电子数为6,D原子最外层电子数为3,A的次外层电子数为2;C原子内层电子总数是最外层电子数10倍,则C为Na,B的原子序数小于钠,则B为O元素;A、B、D三种元素的原子最外层电子数之和为13,则A的最外层为13-6-3=4,所以A的核外电子数为2+4=6,故A为C元素;A和B原子最外层电子数与D和F原子最外层电子数之和相等,则F的最外层为7,F的原子序数最大,故F为Cl元素;D和E是相邻两种元素,D原子最外层电子数为3,所以D为Al元素,E为Si元素.
(1)E为Si元素,基态原子的核外电子排布为1s22s22p63s23p2,占用了8个原子轨道;F元素的名称:氯,故答案为:8;氯;
(2)非金属性C>Si,故最高价含氧酸的酸性较强的是H2CO3,故答案为:H2CO3;
(3)由A、B、C三种元素组成原子个数比n(A):n(B):n(C)=1:3:2的化合物为Na2CO3,碳酸钠中的碳酸根离子会发生水解反应:CO32-+H2O?HCO3-+OH-,所以Na2CO3溶液呈碱性,
故答案为:CO32-+H2O?HCO3-+OH-;
(4)原子的电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,则原子半径最大的为Na;
它们的离子核外电子数相同,核电荷数越大,离子半径越小,则Al3+的半径最小;
D为Al元素,M元素与D元素位于不同主族,但由于二者的电负性相近,则M为Be元素,BeO与氢氧化钠反应生成BeO22-和H2O,其离子方程式为:BeO+2OH-=BeO22-+H2O,
故答案为:Na;Al3+;BeO+2OH-=BeO22-+H2O;
(5)E和F形成的化合物X为SiCl4,SiCl4与氢气制取高纯度的单质Si的化学原理是:SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl,
故答案为:SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$Si+4HCl.
点评 本题考查位置结构与性质关系的应用,题目难度中等,关键是先根据题干信息推断元素,侧重于电子排布和元素周期律知识的综合应用的考查.

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案| A. | 配制银氨溶液:向氨水中加入过量的硝酸银溶液 | |
| B. | 银镜反应:向银氨溶液中滴加葡萄糖溶液后,热水浴 | |
| C. | 检验蔗糖的水解产物:先加碱中和,再滴入新制的氢氧化铜中加热 | |
| D. | 淀粉水解:向淀粉溶液中加入唾液,加热 |
| A. | 将少量Na2O2粉末加入到H218O水中:2H218O+2Na2O2═4Na++4OH-+18O2↑ | |
| B. | 向AlC13溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 氯化亚铁溶液中通入足量C12:Fe2++C12═Fe3++2C1- | |
| D. | 往NH4HSO4溶液中加入足量NaOH溶液:NH4++H++2OH-═NH3•H2O+H2O |
| A. | 基态原子第五电子层只有2个电子,则该原子第四电子层的电子数肯定为8或18个 | |
| B. | 核外电子数为奇数的基态原子,其原子轨道中一定含有未成对电子 | |
| C. | R为第二周期元素,其原子具有的电子层数为最外层电子数的$\frac{1}{2}$,它可能形成的含氧酸根离子有 ①RO${\;}_{3}^{2-}$、②R2O${\;}_{4}^{2-}$、③RO${\;}_{4}^{2-}$ | |
| D. | Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be |

Ⅱ.图B折线c可以表达出第IA族元素氢化物的沸点的变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:b(填“a”或“b”)
Ⅲ.部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 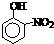 |  | 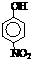 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
有机物相对分子质量越大,分子间作用力越强,故沸点越高,当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高.
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母):
a.2个σ键;b.2个π键;c.1个σ键.1个π键.
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
Ⅰ.Ti元素的基态原子的价电子层排布式为3d24s2;
Ⅱ.已知Ti3+可形成配位数为6的配合物.现有紫色和绿色两种含钛晶体,其组成均为TiCl3•6H2O.为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的$\frac{2}{3}$.则绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
| A. | 乙烯 | B. | 苯 | C. | 乙醛 | D. | 甲酸钠 |
 或
或 .
.
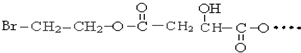
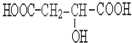 请回答:
请回答: .
.