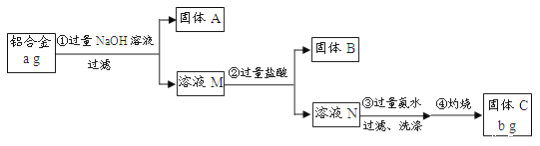
题目内容
【题目】25℃时,向某二元弱酸H2X的钠盐溶液中滴加盐酸,混合溶液中离子浓度与pH的关系如图所示,其中lgX = ![]() 或
或![]() 。下列叙述不正确的是
。下列叙述不正确的是
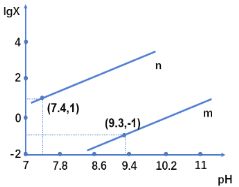
A. 曲线m表示![]() 与pH的变化关系
与pH的变化关系
B. Ka1(H2X)的数量级为10-7
C. 当溶液呈中性时, c(HX-)>c(X2-)>c(H2X)
D. 25℃时,NaHX溶液中:c(OH-)>c(H+)
【答案】C
【解析】
A. 因为H2X为二元弱酸,Ka1>>Ka2, 所以X2-的水解程度大,碱性强,故曲线m表示![]() 与pH的变化关系是正确的;B.当
与pH的变化关系是正确的;B.当![]() =1时,10c(H2X)= c(HX-),pH=7.4,c(H+)=10-7.4此时, Ka1(H2X)=c(H+)
=1时,10c(H2X)= c(HX-),pH=7.4,c(H+)=10-7.4此时, Ka1(H2X)=c(H+)![]() c(HX-)/c(H2X)=10-7.4
c(HX-)/c(H2X)=10-7.4 ![]() 10=10-6.4, Ka1(H2X)的数量级为10-7是正确的,故B正确;C.由图可知当溶液呈中性时,
10=10-6.4, Ka1(H2X)的数量级为10-7是正确的,故B正确;C.由图可知当溶液呈中性时,![]() <0, c(X2-)< c(HX-);当
<0, c(X2-)< c(HX-);当![]() >0
>0
c(HX-)> c(H2X),因为水解大于电离,所以(H2X)> c(X2-),故C错误; D.由图可知,当![]() =0即c(HX-)=c(HX-)时 ,pH>9.3,溶液显碱性,所以水解大于电离,NaHX溶液显碱性,c(OH-)>c(H+),故D正确;答案:C。
=0即c(HX-)=c(HX-)时 ,pH>9.3,溶液显碱性,所以水解大于电离,NaHX溶液显碱性,c(OH-)>c(H+),故D正确;答案:C。

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
【题目】在密闭容中加入2.0molSO2和1.0molO2,一定条件下发生如下反应2SO2+O2![]() 2SO3。反应达到平衡后,各物质的物质的量可能为( )
2SO3。反应达到平衡后,各物质的物质的量可能为( )
n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
A | 2.0 | 1.0 | 0 |
B | 1.0 | 0.8 | 1.0 |
C | 0.20 | 0.10 | 1.80 |
D | 0 | 0 | 2.0 |
A. AB. BC. CD. D