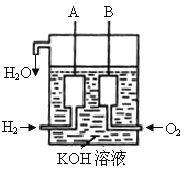
题目内容
【题目】用A+、B-、C2-、D、E、F分别表示含有18个电子的几种微粒(离子或分子),请回答下列问题:
(1)A元素是________、B元素是________、C元素是_______(用元素符号表示)。
(2)B的单质可用来制“84”消毒液的主要成分,写出反应的离子方程式________________。
(3)用文字描述比较B、C两元素的非金属性强弱的方法(必要时可用方程式,至少一条):___________________________________。
(4)D是由两种元素组成的双原子分子,用电子式表示其形成过程________________。
(5)E是所有含18个电子的微粒中氧化能力最强的分子,其与水反应的化学方程式为___________________。
(6)F分子中含有4个原子,既有极性键又有非极性键,其电子式是_________。
【答案】 K Cl S Cl2+2OH-=Cl-+ClO-+H2O Cl2+S2-=2Cl-+S或Cl2+H2S=2HCl+S2- ![]() +
+![]()
![]()
![]() 2F2+2H2O=4HF+O2
2F2+2H2O=4HF+O2 ![]()
【解析】(1)A+、B-、C2-、D、E、F分别表示含有18个电子的几种微粒(离子或分子),则A元素是K,B元素是Cl,C元素是S。(2)氯气与氢氧化钠溶液反应制“84”消毒液,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。(3)根据强置弱可知反应Cl2+S2-=2Cl-+S或Cl2+H2S=2HCl+S2-可以说明氯元素非金属性强于硫元素。(4)D是由两种元素组成的双原子分子,D是HCl,用电子式表示其形成过程为![]() 。(5)E是所有含18个电子的微粒中氧化能力最强的分子,E是单质氟,其与水反应的化学方程式为2F2+2H2O=4HF+O2。(6)F分子中含有4个原子,既有极性键又有非极性键,F是双氧水,其电子式是
。(5)E是所有含18个电子的微粒中氧化能力最强的分子,E是单质氟,其与水反应的化学方程式为2F2+2H2O=4HF+O2。(6)F分子中含有4个原子,既有极性键又有非极性键,F是双氧水,其电子式是![]() 。
。

 寒假学与练系列答案
寒假学与练系列答案【题目】某学生用0.1000 molL﹣1KOH液滴定未知浓度的醋酸,其操作分解为如下几步: A.移取20mL待测醋酸注入洁净的锥形瓶,并加入2~3滴指示剂
B.用标准溶液润洗滴定管2~3次
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D.取标准KOH入碱式滴定管至“0”刻度以上1~2cm
E.调节液面至“0”或“0”以下某一刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写);
(2)上述B步骤操作的目的是;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对最终滴定结果的影响是 . (填“增大”、“减小”、或“不变”)
(4)A步骤中,使用的指示剂为 , 判断到达滴定终点的实验现象是:;
(5)如图1为某一次碱式滴定管滴定前液面,其读数值为mL,图2为滴定结束液面,则本次滴定过程共使用了mLKOH标准溶液 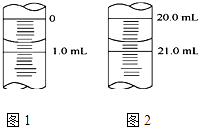
(6)为标定某醋酸溶液的准确浓度,用0.1000molL﹣1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为 . (保留小数点后四位)