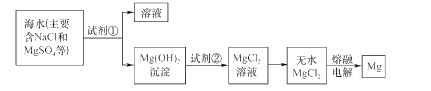
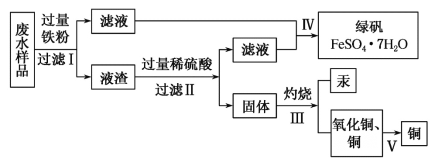
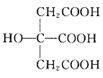
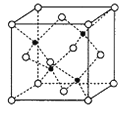
题目内容
【题目】对下列装置的叙述错误的是( )

A. X如果是硫酸铜,a和b分别连接直流电源正、负极,一段时间后铁片质量增加
B. X如果是氯化钠,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程
C. X如果是硫酸铁,则不论a和b是否用导线连接,铁片均发生氧化反应
D. X如果是氢氧化钠,将碳电极改为铝电极,a和b用导线连接,此时构成原电池铁作负极
【答案】D
【解析】
试题A、a作阳极,b作阴极,Cu2+在阴极得电子,Cu2++2e-=Cu,铁片质量增加,故A说法正确;B、构成原电池,发生吸氧腐蚀,铁片作负极,Fe-2e-=Fe2+,故B说法正确;C、都发生Fe+2Fe3+=3Fe2+,化合价升高,被氧化,故C说法正确;D、形成原电池条件之一:能跟电解质溶液反应,铝作负极,故D选项说法错误。

【题目】(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。