题目内容
【题目】SnSO4用于合金、马口铁、汽缸活塞、钢丝等酸性电镀,电子器件的光亮镀锡等.另外,还用于铝合金制品涂层氧化着色,印染工业用作媒染剂,有机溶液中双氧水去除剂等.工业上SnSO4的制备路线如图: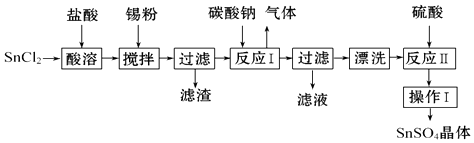
已知:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化.
Ⅱ.SnCl2易水解生成碱式氯化亚锡.
回答下列问题:
(1)锡原子的核外电子数为50,与碳元素同主族,锡元素在周期表中的位置是 .
(2)操作Ⅰ是、、过滤、洗涤.
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因: .
(4)加入锡粉的作用有两个:①调节溶液pH,② .
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 .
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 .
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,反应为Sn+2HCl═SnCl2+H2↑;
②加过量FeCl3氧化Sn2+生成Sn4+;
③用已知浓度的盐酸酸化过的K2Cr2O7滴定生成的FeCl2 , 反应的化学方程是:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O.
取1.360g锡粉,经上述各步反应后,共用去0.100molL﹣1K2Cr2O7溶液33.00mL,则锡粉中锡的质量分数是 . (保留一位小数)
【答案】
(1)第5周期ⅣA族
(2)蒸发浓缩,冷却结晶
(3)SnCl2+H2O?Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+的水解
(4)防止Sn2+被氧化
(5)Sn2++CO32﹣═SnO↓+CO2↑
(6)Sn2++H2O2+2H+═Sn4++2H2O
(7)86.6%
【解析】解:(1)锡原子的核电荷数为50,与碳元素属于同一主族,处于ⅣA族,其原子核外有5个电子层,所以位于第5周期第IVA族;
(2)从溶液中获取晶体采用蒸发浓缩、冷却结晶、过滤、洗涤的方法,所以操作I是蒸发浓缩、冷却结晶;
(3)由信息可知,SnCl2易水解生成碱式氯化亚锡,存在平衡Sn Cl2+H2OSn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;
(4)由信息可知,Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;
(5)反应Ⅰ得到沉淀是SnO,Sn元素化合价为变化,属于非氧化还原反应,同时生成气体,该气体为二氧化碳,离子方程式为:Sn2++CO32﹣═SnO↓+CO2↑,
所以答案是:Sn2++CO32﹣═SnO↓+CO2↑;
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,双氧水有强氧化性,将Sn2+易被氧化为Sn4+,自身被还原为水,离子方程式为:Sn2++H2O2+2H+═Sn4++2H2O,
所以答案是:Sn2++H2O2+2H+═Sn4++2H2O.(7)令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~ |
|
119g |
|
1.360g×x | 0.100mol/L×0.033L |
故119g: ![]() mol=(1.360g×x):(0.100mol/L×0.033L)
mol=(1.360g×x):(0.100mol/L×0.033L)
x= ![]() =86.6%,
=86.6%,
所以答案是:(1)第5周期ⅣA族;(2)蒸发浓缩;冷却结晶;(3)SnCl2水解,发生SnCl2+H2OSn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;(4)防止Sn2+被氧化;(5)86.6%.

【题目】乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
(1)【观察与思考】 乙醇分子的核磁共振氢谱有个吸收峰.
(2)【活动与探究】 (i)甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现象.请在下表中将观察到的实验现象及结论补充完全(有多少现象等就填多少,不必填满).
实验现象 | 结 论 | |
① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
② |
(ii)乙同学向试管中加入3~4mL无水乙醇,浸入50℃左右的热水中,再将铜丝烧至红热,迅速插入乙醇中,反复多次.则此时乙醇发生反应的化学方程式为(生成乙醛) . 欲验证此实验的有机产物,可以将产物加入盛有的试管中并在酒精灯火焰上直接加热,观察现象即可,此反应的化学方程式为 .
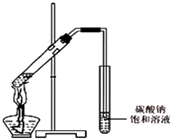
(3)【交流与讨论】 丙同学向一支试管中加入3mL 乙醇,然后边摇动试管边慢慢加入2mL浓硫酸和2mL冰醋酸,按下图所示连接好装置,请指出该装置的主要错误是 . 假如乙醇分子中的氧原子为18O原子,则发生此反应后,18O原子将出现在生成物中(填字母).
A.水 B.乙酸乙酯 C.水和乙酸乙酯.