题目内容
【题目】钼酸钠晶体( Na2MoO42H2O)是一种无公害型冷却水系统的金属缓蚀剂.工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图1所示: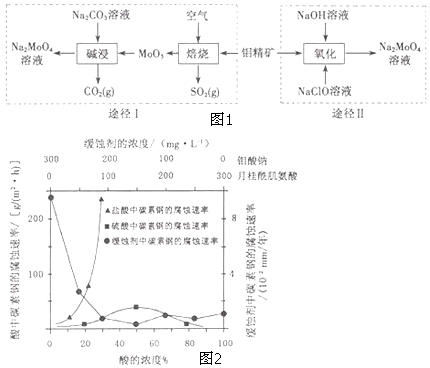
(1)NaClO的电子式是 .
(2)为了提高焙烧效率,除增大空气量外还可以采用的措施是 .
(3)途径I碱浸时发生反应的离子方程式为 .
(4)途径Ⅱ氧化时发生反应的离子方程式为 .
(5)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂.常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图2:
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为 .
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 .
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 .
【答案】
(1)![]()
(2)充分粉碎或逆流焙烧
(3)MoO3+CO32﹣=MoO42﹣+CO2↑
(4)MoS2+9ClO﹣+6OH﹣=MoO42﹣+9Cl﹣+2SO42﹣+3H2O
(5)1:1,常温下浓硫酸具有强氧化性,会使铁钝化,Cl﹣有利于碳钢的腐蚀,SO42﹣不利于碳钢的腐蚀
【解析】解:(1)离子化合物NaClO的电子式为 ![]() ;
;
(2)提高焙烧效率,除增大空气量外还可以采用的措施是充分粉碎或逆流焙烧;
(3)途径I碱浸时发生反应的离子方程式为MoO3+CO32﹣=MoO42﹣+CO2↑;
(4)途径Ⅱ用NaClO在碱性条件下氧化MoO3,发生反应的离子方程式为MoS2+9ClO﹣+6OH﹣=MoO42﹣+9Cl﹣+2SO42﹣+3H2O;
(5)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好,即浓度比为1:1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用;
③由图示数据可知,碳钢在盐酸中的腐蚀速率明显快于硫酸的腐蚀速度;硫酸浓度增大变成浓硫酸后,发生了钝化现象,腐蚀速度很慢;
所以答案是:(1) ![]() ;(2)充分粉碎或逆流焙烧;(3)MoO3+CO32﹣=MoO42﹣+CO2↑;(4)MoS2+9ClO﹣+6OH﹣=MoO42﹣+9Cl﹣+2SO42﹣+3H2O;(5)①1:1;②常温下浓硫酸具有强氧化性,会使铁钝化;③Cl﹣有利于碳钢的腐蚀,SO42﹣不利于碳钢的腐蚀.
;(2)充分粉碎或逆流焙烧;(3)MoO3+CO32﹣=MoO42﹣+CO2↑;(4)MoS2+9ClO﹣+6OH﹣=MoO42﹣+9Cl﹣+2SO42﹣+3H2O;(5)①1:1;②常温下浓硫酸具有强氧化性,会使铁钝化;③Cl﹣有利于碳钢的腐蚀,SO42﹣不利于碳钢的腐蚀.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】研究铜及其化合物的性质对科研、生产生活有重要的意义.
(1)铜可采用如下方法制备
①火法炼铜:Cu2S+O2![]() 2Cu+SO2
2Cu+SO2
②湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被 (填“氧化”或“还原”)成铜单质,若用①法每制得32gCu,转移电子的物质的量是 .
(2)在潮湿的空气中铜可以发生电化学腐蚀,生成铜绿,铜绿的化学式为 发生腐蚀的正极反应式为 ,由铜和锌组成的黄铜合金不易生锈,其防腐蚀的方法是 .
(3)①Li﹣﹣CuO电池总反应为:2Li+CuO═Li2O+Cu.电解质溶液为高氯酸锂有机溶液,电池的正极反应式为 .
②Cu2O是一种半导体材料,可在碱性溶液中用电解法制取,电解总反应式为:
2Cu+H2O![]() Cu2O+H2↑,阳极反应式为 ;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式 .
Cu2O+H2↑,阳极反应式为 ;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式 .
(4)为了回收粗铜精炼后阳极泥中的Ag和Au,某实验小组查阅了有关资料如下表:
编号 | 常温下反应 | 化学平衡常数 |
反应甲 | Au+6HNO3Au(NO3)3+3NO2↑+3H2O | <10﹣5 |
反应乙 | Au3++4Cl﹣[AuCl4]﹣ | >105 |
从资料中可知,常温下金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸体积比为l:3的混合物).请你运用化学平衡移动原理,简要说明金能溶于王水的原因 .