题目内容
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中可以使0.1mol/L CH3COOH溶液中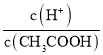 值增大的措施是_____
值增大的措施是_____
A.加水稀释 B.加入少量CH3COONa固体
C.加入少量冰醋酸气体 D.通入少量HCl
(2)t℃时,水的离子积常数KW=1×10-12。该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液等体积混合后溶液呈中性,则a+b=___________。
(3)常温下,有等pH的三种溶液:a.NaHCO3 b.NaClO c.CH3COONa,三种溶液浓度由大到小的顺序为:_______________(填序号)
(4)已知25℃时,Ksp(AgCl)= 1.8×10-10,现将足量氯化银分别放入:
a.100mL 蒸馏水中 b.100mL 0.2mol/L AgNO3 溶液中
c.100mL 0.1mol/L氯化铝溶液中 d.100mL 0.1mol/L盐酸溶液中
充分搅拌后,相同温度下银离子浓度由大到小的顺序是______________(填序号);b中氯离子浓度为_____________mol/L
【答案】AD 14 c>a>b b>a>d>c 9×10-10
【解析】
1)要使溶液中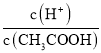 值增大,应是平衡向电离的方向移动;
值增大,应是平衡向电离的方向移动;
(2)该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,应存在n(H+)=n(OH-);
(3)酸性越强,水解程度越弱;
(4)氯化银饱和溶液中存在沉淀溶解平衡,饱和溶液中的溶度积是常数,只随温度变化,依据溶度积分别计算;100mL 0.2mol/L AgNO3溶液中,银离子的浓度为0.2mol/L,根据氯化银的Ksp=1.8×10-10计算.
:(1)A.加水稀释,pH正向移动,溶液中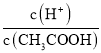 值增大,故A正确;
值增大,故A正确;
B.加入少量CH3COONa固体,醋酸根离子浓度增大,抑制醋酸的电离,则溶液中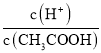 值减小,故B错误;
值减小,故B错误;
C.加入少量冰醋酸,醋酸浓度增大,平衡逆向移动,则溶液中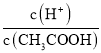 值减小,故C错误;
值减小,故C错误;
D.通入少量HCl气体,氢离子浓度增大,则溶液中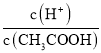 值增大,故D正确;
值增大,故D正确;
故答案为:AD;
(2)该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则100×10-a=1×10b-12,则2-a=b-12,a+b=14,故答案为:14;
(3)已知酸性醋酸>碳酸>次氯酸,则酸越强,对应的钠盐的pH越小,若pH相同则浓度c>a>b,故答案为:c>a>b;
(4)100mL 0.2molL-1AgNO3溶液中Ag+浓度为0.2mol/l抑制沉淀溶解平衡,c100mL 0.1molL-1氯化铝溶液中氯离子浓度为0.3mol/L,银离子浓度=6×10-10mol/L;d100mL 0.1molL-1盐酸溶液中氯离子浓度为0.1mol/L,银离子为1.8×10-9mol/L;综上所述大小顺序为b>a>d>c,100mL 0.2mol/L AgNO3溶液中,银离子的浓度为0.2mol/L,加如氯化银后,氯离子浓度为1.8×1010/0.2=9×10-10mol/L,故答案为:b>a>d>c;9×10-10.

 优等生题库系列答案
优等生题库系列答案【题目】在25 ℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如表所示:
AgCl | AgI | Ag2S | |
Ksp | 1.8×1010 | 8.3×1017 | 6.3×1050 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同