题目内容
7.法国化学家伊夫•肖万获2005年诺贝尔化学奖.他发现了烯烃里的碳碳双键会被拆散、重组,形成新分子,这种过程被命名为烯烃复分解反应(该过程可发生在不同烯烃分子间,也可发生在同种烯烃分子间).如: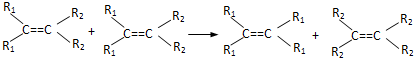
则对于有机物
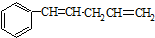 发生烯烃的复分解反应时,不可能生成的产物是( )
发生烯烃的复分解反应时,不可能生成的产物是( )| A. | 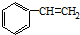 | B. | 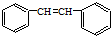 | C. | CH2=CHCH3 | D. | 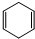 |
分析 根据题所给信息烯烃在合适催化剂作用下可双键断裂,两端基团重新组合为新的烯烃解题,对于有机物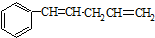 发生烯烃的复分解反应时,C6H5CH═CHCH2CH与═CH2发生在双键位置的断裂或C6H5CH与═CHCH2CH═CH2发生在双键位置的断裂或两种断裂情况同时发生C6H5CH与═CHCH2CH与═CH2发生在双键位置的断裂,断裂后的基团进行组合重新形成双键.
发生烯烃的复分解反应时,C6H5CH═CHCH2CH与═CH2发生在双键位置的断裂或C6H5CH与═CHCH2CH═CH2发生在双键位置的断裂或两种断裂情况同时发生C6H5CH与═CHCH2CH与═CH2发生在双键位置的断裂,断裂后的基团进行组合重新形成双键.
解答 解:因烯烃在合适催化剂作用下可双键断裂,两端基团重新组合为新的烯烃,对于有机物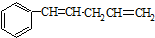 发生烯烃的复分解反应时,C6H5CH═CHCH2CH与═CH2发生在双键位置的断裂,可形成C6H5CH═CHCH2CH=CHCH2CH═CHC6H5、CH2═CH2,C6H5CH与═CHCH2CH═CH2发生在双键位置的断裂,可形成C6H5CH=CHC6H5故B正确,CH2═CHCH2CH═CHCH2CH═CH2、两种断裂情况同时发生可形成C6H5CH═CH2故A正确,、═CHCH2CH═与═CHCH2CH═,可以生成
发生烯烃的复分解反应时,C6H5CH═CHCH2CH与═CH2发生在双键位置的断裂,可形成C6H5CH═CHCH2CH=CHCH2CH═CHC6H5、CH2═CH2,C6H5CH与═CHCH2CH═CH2发生在双键位置的断裂,可形成C6H5CH=CHC6H5故B正确,CH2═CHCH2CH═CHCH2CH═CH2、两种断裂情况同时发生可形成C6H5CH═CH2故A正确,、═CHCH2CH═与═CHCH2CH═,可以生成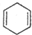 故D正确,不可能生成的产物是CH2=CHCH3,
故D正确,不可能生成的产物是CH2=CHCH3,
故选C.
点评 本题考查同分异构体,读懂题目所给的信息是解题的关键,可以是同种分子,也可以是不同分子发生“复分解反应”,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.有A、B两种烃,含碳的质量分数相同,下列关于A和B的叙述中正确的是( )
| A. | A和B一定是同分异构体 | |
| B. | A和B不可能是同系物 | |
| C. | A和B的最简式相同 | |
| D. | A和B各1mol完全燃烧后生成的二氧化碳的质量一定相等 |
15.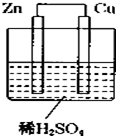 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
实验后的记录:
①Zn为正极,Cu为负极
②Cu极上有气泡产生,发生还原反应
③SO42-向Zn极移动
④若有0.5mol电子流经导线,则产生5.6L气体
⑤电流的流向是:Cu→Zn
⑥负极反应式:Cu-2e-═Cu2+,发生氧化反应.
 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )实验后的记录:
①Zn为正极,Cu为负极
②Cu极上有气泡产生,发生还原反应
③SO42-向Zn极移动
④若有0.5mol电子流经导线,则产生5.6L气体
⑤电流的流向是:Cu→Zn
⑥负极反应式:Cu-2e-═Cu2+,发生氧化反应.
| A. | ②④⑤ | B. | ②③⑤ | C. | ①④⑥ | D. | ③④⑤⑥ |
2.2003年诺贝尔化学奖授予两位美国科学家,其中一位是阿格雷(Pete Agre),表彰他最先发现并表征了细胞膜上的水通道蛋白质,并把这种蛋白质暂命名为:CHIP28,下列关于CHIP28的说法中正确的是( )
| A. | 这种蛋白质为人工合成的高分子化合物 | |
| B. | 这种蛋白质遇到HgCl2的浓溶液将发生盐析 | |
| C. | 这种蛋白质能完全水解生成单糖分子 | |
| D. | 这种蛋白质分子中存在“-CONH-”的结构 |
3.下列关于苯的说法正确的是( )
| A. | 无毒 | |
| B. | 密度比水大 | |
| C. | 既可发生取代反应又可发生加成反应 | |
| D. | 分子的结构特点是单、双键交替 |
4.下列文字表述与反应的离子方程式对应且正确的是( )
| A. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| B. | Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-═9Fe3++NO2↑+14H2O | |
| C. | NaHSO4溶液与Ba(OH)2溶液混合后显中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O |
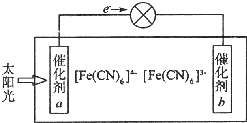 铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.
铁、铜等金属及其化合物在日常生活中应用广泛,回答下列问题.
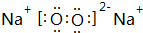 ,这一反应是放热(填“吸热”、“放热”)反应;元素②和④形成化合物电子式为
,这一反应是放热(填“吸热”、“放热”)反应;元素②和④形成化合物电子式为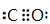 、
、 ;
;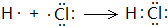 ;
;